(I)Gram染色(各自)
|
| |
最も基本的な染色法である。実習ではキットによる染色を行う。Gram染色は熟練が必要で、脱色し過ぎによるミス(陽性菌が陰性菌に見える)が多い。臨床の場でたまに染色するときにもキットを用いることをすすめる。 |
| |
|
| (1) |
塗抹 |
| |
- スライドガラスにガラス鉛筆で3つの円を書き、滅菌水(水道水でも可)を 1滴、白金耳で取る。水を取りすぎると、菌をつけた後乾燥しにくいので極少量にすること。平板上のコロニー(または試験管)から菌を極少量、無菌的に取り、スライドガラス上の水につけ、広げる。とかく菌を取りすぎるので注意。乾いた時薄く曇る程度がよい。
- ブドウ球菌をとり、左の円の中に塗抹し、そのまま中央の円の中にも塗抹する。ついで大腸菌を右の円に塗抹し、中央の円の中にも塗抹する。
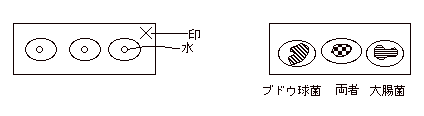
|
| (2) |
乾燥 |
| |
空気中で自然乾燥するのがよい。つけた水が多すぎるときは、ガスバーナーの炎から十分に距離をおいた所にかざして乾燥する。決してスライドガラス上の菌液を沸騰させてはいけない。 |
| (3) |
固定 |
| |
菌液が乾燥したら、塗抹面を上にして火炎の中をゆっくりと3回通過させる。 |
| (4) |
染色 |
| |
ピンセットを用いてスライドガラスを扱うこと。手で扱うと手が染色される。 |
| |
- 青いA液を円の中に盛り上げるように、スポイトで滴下する。約1分間染色。
- 水道水で水洗する。強い水の流れが菌に触れないように、まずスライドガラスの裏面を洗い、水流を弱くして表側を洗うとよい。
- 水を切り、黄色い脱色液をかける。A液の青色が溶け出してくるので、脱色液を捨てもう一度脱色液をかける。青色が溶け出さなくなったら、2と同様に水洗。
- 赤いB液を滴下し、1分間染色。
- 水道水で水洗し、乾燥してから鏡検する。
Gram陽性=青(紫)、 Gram陰性=赤
|
| |
Gram原法 |
Hucker変法 |
キット |
| 第1染色液 |
石炭酸ゲンチアナ紫 |
クリスタル紫 |
ビクトリアブルー(A液) |
| 媒染剤 |
ルゴール |
ルゴール |
脱色液に含まれている |
| 脱色 |
純アルコール |
純アルコール |
脱色液 |
| 対比染色 |
サフラニン |
サフラニン |
サフラニン(B液) |
|
| |
|
|
| [問い] |
| 菌によりGram陽性、陰性と分かれるのはなぜか?陽性菌と陰性菌はどう違うか? |
| |
|
| [リウの方法](各自) |
グラム陽性菌と陰性菌を簡単に鑑別できる方法である。
ブドウ球菌(またはレンサ球菌)を白金耳で釣菌しスライドガラスに塗り付ける。少し離してグラム陰性かん菌(大腸菌)を塗り付ける。菌量が少し多い方が、結果が分かりやすい。白金耳を滅菌し、3 % KOH をとりブドウ球菌につける。菌を懸濁するよう混ぜる。白金耳を滅菌し、新しく 3 % KOH をとり、大腸菌につける。菌を懸濁するように混ぜる。ブドウ球菌には変化が無いが、大腸菌を混ぜた白金耳を持ち上げると、糸を引く。 |
| |
|
[問い]
リウの方法で、糸を引くように見えた物は何か。 |
| |
|
(II)抗酸菌染色(Ziehl-Neelsen 染色)(各自)
M. tuberculosis は、たいへん危険な菌である。医原性感染も多い。ここでは、常在菌である M. smegmatis を用いて、染色法を実習する。M. tuberculosis については、染色された喀痰を鏡検する(東大病院の外来症例である)。 |
| |
| [準備] |
| (1) |
チールの石炭酸・フクシン液 |
| (2) |
塩酸エタノール(3%濃塩酸、97%エタノール) |
| (3) |
レフレルのメチレンブルー液 |
| (4) |
クレゾール石鹸液と海砂の入った試験管 |
| (5) |
白金耳 |
| (6) |
スライドガラス |
| (7) |
ガラス鉛筆 |
| |
|
| [染色](各人) |
| (1) |
スライドガラスに少量の生理的食塩水を3箇所つける(水だと菌の凝集がほぐれにくい)。M. smegmatis のはえた試験管から無菌的に少量の菌を白金耳で取り、スライドガラス上の左の生食にこすりつける。まわりに飛び散らないように気をつけながら菌をほぐし、そのまま中央、そして右の生食にも菌を広げる。菌を塗ったら、白金耳はすぐに焼かず、ひとまず、クレゾール石鹸液の入った試験管に入れる。それから白金耳を焼く。(結核菌の感染は aerosol によることが多い。菌のついた白金耳をすぐに焼くと、菌が飛び散る可能性があり、ひとまず白金耳を消毒液に入れるわけである)。 |
| (2) |
スライドガラスを自然乾燥する。 |
| (3) |
乾いたら塗抹面を上にして、火炎の中を3回くらいゆっくりと通過させ固定する。 |
| (4) |
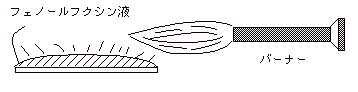
固定した標本を水平に置き、赤いチールの石炭酸・フクシン液を注ぐ(全体を覆うように)。 |
| (5) |
バーナーの炎でチールの石炭酸・フクシン液を加温する。金属光沢が出、湯気が出てきたら加温をやめ、約10分間静置。 |
| |
 |
| (6) |
染色液を捨て、軽く水洗。 |
| (7) |
塩酸エタノールで脱色する。塗抹の薄いところが無色になるまで脱色するが、
菌の固まりは脱色されにくい。 |
| (8) |
水洗し、青いレフレルのメチレンブルー液で10〜20秒間、後染色し水洗、乾燥する。この方法では、抗酸菌菌は赤く、細胞等の背景は青く染まる。 |
| (9) |
大腸菌やブドウ球菌も Ziehl-Neelsen 染色で染めてみて抗酸菌と比較すると良い。 |
| |
|
[喀痰標本の鏡見]
東大病院の外来患者の塗抹標本をデモでみせる。喀痰標本は、約5分間程度時間をかけ、塗抹された部分のほぼ全域を見るのが臨床のルーチンである。抗酸菌が検出されればガフキー(Gaffky)の号数により、検出菌数の多少を表わす。 |
| |
簡便記載法 + + ++ ++ ++ ++ +++ +++ +++ +++
|
【C−2】口腔内常在細菌(各人)
口腔内の細菌を鏡検したり、培養したりすることにより正常細菌そう(normal bacterial flora)につき実習する。 |
| |
|
| [準備] |
| (1) |
血液寒天 人数分。 |
| (2) |
マンニット食塩寒天 人数分。 |
| (3) |
滅菌綿棒 4本/人。 |
| (4) |
グラム染色キット 1式/班。 |
| (2日目) |
| (3)普通寒天 1枚/班(抗生物質感受性のための菌を取っておくため) |
| |
|
| [1]血液寒天による口腔内細菌の培養 |
各自血液寒天を受け取り、裏に学籍番号、氏名、班名、日付をマジックで書く。滅菌綿棒で自分の口腔内をぬぐい、血液寒天の一部に塗り付ける。そこから、白金耳を用いて colony isolationできるように streaking の要領で画線し、倒立させて 37℃、一晩培養する。
口腔内と鼻腔内では常在細菌叢が異なる。各班のうち何人かはプレートの裏にマジックで半分に仕切りを入れ、半分には口腔内からの材料を塗り付け、残りの半分には鼻腔内からの材料を塗るとよい。
|
| |
| [2]マンニット食塩寒天によるブドウ球菌の分離。 |
| マンニット食塩寒天は、7.5 % の NaCl を含んだブドウ球菌の選択培地である(Bacillus, Micrococcus, Vibrio などもはえる)。ブドウ球菌のところで実習するが、マンニットを分解できる黄色ブドウ球菌と、非分解の表皮ブドウ球菌などとを容易に鑑別できる。
各自マンニット食塩寒天を受け取り、裏にマジックで学籍番号、氏名、班名、日付を書き、さらに直線でプレ−トを3つに仕切る。仕切った1区画には、滅菌綿棒で自分の右鼻腔をぬぐいその綿棒を塗り付ける。同様に、新しい綿棒を使って左鼻腔、咽頭をぬぐい、残った区画に塗り付ける。ブドウ球菌は、口腔よりも鼻腔から培養されることが多く、材料は鼻腔と咽頭とする。マンニット食塩寒天は選択培地であるため画線はいらず、綿棒で塗り付けるだけでよい。ブドウ球菌の分離頻度、薬剤耐性などを検査するので、材料を塗ったマンニット食塩寒天は各自で培養せず、スタッフに提出して一括して培養する。翌日の実習までに各自に返却する。
★翌日、各班ごとに一人を選んで、マンニット食塩寒天上のブドウ球菌(S. aureusでも S. epidermidisでも可だが、どちらであるかは判断しておくこと)の1コロニーをとり、普通寒天にぬりつける。抗生物質感受性に使うのでスタッフにわたして培養してもらう。 |
| |
| [3]口腔内細菌の染色 |
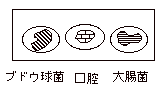
各自、自分の口腔内細菌をグラム染色してみよう。
スライドガラスに水を極少量取り、自分の歯肉を綿棒でこすり、その綿棒でのせガラスに塗抹する。両側に大腸菌と、ブドウ球菌(またはレンサ球菌)を対照として置くとよい。
 |
【C−3】グラム陽性球菌(班単位)
ブドウ球菌(Staphylococcus)及びレンサ球菌(Streptococcus)について実習する。
血液寒天上に培養された、以下のグラム陽性球菌が各班に一組ずつ渡される。 |
| |
|
| ブドウ球菌 |
| |
- Staphylococcus aureus (黄色ブドウ球菌)
- Staphylococcus epidermidis (表皮ブドウ球菌)
|
| レンサ球菌 |
| |
- Streptococcus pyogenes (A群 β‐hemolytic Streptococcus)★
- A群以外の β‐hemolytic Streptococcus
- Streptococcus pneumoniae (肺炎球菌)
- Streptococcus viridans (緑色レンサ球菌群)☆
- nonhemolytic Streptococcus
|
| |
|
★いわゆる溶連菌のこと。
Streptococcus pyogenes というのは学名である。
A群というのは Lancefield 血清型別分類である。
β‐hemolytic というのは溶血パターンを示す。
☆ viridans group とも呼ばれ、α溶血を示す多くの口腔・上気道常在細菌が 含まれる。S. sanguis, S. salivarius, S. mutans, S. mitis, S. anginosus など。
2, 4, 5 は年によって出る菌の種類が異なる可能性がある。 |
| |
|
| [準備] |
| (1) |
班の数(15)+1ずつ上記の菌を血液寒天で培養しておく。 |
| (2) |
スライドガラス |
| (3) |
過酸化水素水(3% H2O2)を 15 ml 位のチューブにいれスポイトを添える。 |
| (4) |
マンニット食塩寒天 1枚/班 |
| (5) |
血液寒天(バシトラシン、オプトヒン用) 2枚/班 |
| (6) |
バシトラシンディスク、オプトヒンディスク 各2枚/班 |
| (7) |
ウサギプラスマを HI ブロスに溶き、滅菌小試に〜 1 ml
x 2本/班 |
| |
|
| [1]集落の観察 |
| |
レンサ球菌は、血液寒天上で特徴のある溶血パターン◆をしめす。 |
| |
α溶血― |
不完全溶血で colony 周囲に緑褐色の環ができる。 |
| |
β溶血― |
完全溶血で colony 周囲が透明となり境界が鮮明。 |
| |
γ溶血― |
非溶血 |
| |
|
◆
通常の血液寒天は、羊の血球を用いている。同じ菌でも、血液寒天中の血液が変わると溶血パターンが変わることがある。
ブドウ球菌で溶血を示すものもあるが、ブドウ球菌を溶血パターンで 分類することはない。 |
| |
|
| [2]カタラーゼ試験(各人) |
| カタラーゼ産生能は、ミクロコッカス科(ブドウ球菌属が含まれる)の菌種に共通している性質で、これを産生しえないレンサ球菌属(ストレプトコッカス科に含まれる)との鑑別に役立つ。配られた7種類の菌についてやってみる。 |
| |
|
| [操作] |
| (1) |
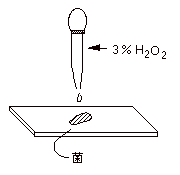
寒天に触れないようにして白金耳で無菌的に釣菌し、スライドガラスにそのまま塗り付ける。1枚のスライドガラスに3種類の菌を、離して塗り付ける。 |
| (2) |
過酸化水素水(3% H2O2)を一滴、菌の上にたらす(次図参照)。激しく気泡(酸素)が発生するか否かで、カタラーゼ陽性か陰性かを判定する。
 |
| |
|
|
【これ以後はブドウ球菌とレンサ球菌に分けて実習する】
|
(I)ブドウ球菌
|
| (1) |
コアグラーゼ試験(班単位)
コアグラーゼの産生は、ブドウ球菌属の中では、黄色ブドウ球菌、S. intermedius にみられ、表皮ブドウ球菌等のCNS(Coagulase-Negative Staphylococci;17種くらい有り)との鑑別に役立つ。菌とウサギ(またはヒト)血漿とを混合して37℃に保温するとフィブリンが析出して血漿の凝固が起こる反応を見る(長く置きすぎるとフィブリノリジンにより形成されたフィブリンが分解される)。最近ではフィブリノーゲン感作ヒツジ赤血球を用いて、菌体との凝集反応を見る迅速法も実用化されている。 |
| |
| |
[操作] |
|
| |
(1)
|
S. aureus, S. epidermidis
を各々白金線で無菌的に釣菌し、ウサギプラスマの入った小試に、別々にうえる(各班1対ずつ)。小試にマジックで菌名、班名を記入し、37℃で培養。 |
| |
(2) |
翌日、小試を静かに傾け、凝固の有無を検査する(実際には、数時間後も見ておくことが望ましい) |
| |
|
| (2) |
マンニット食塩寒天での培養(班単位) |
| |
食塩抵抗性が強く、7%食塩を含む培地中でも発育できるのがブドウ球菌の特徴である。一方、
S. aureus はマンニットを発酵分解するが、S. epidermidis は分解しない。高食塩下での発育とマンニット分解能を検査するための培地がマンニット食塩寒天である。 |
| |
[操作] |
|
| |
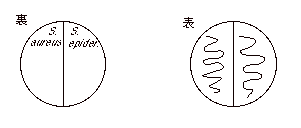
(1) |
マンニット食塩寒天の裏にマジックで線を引き、
S. aureus, S. epidermidis と別の区画に記入。 |
| |
(2) |
各々の菌を釣菌し、各々の区画に各々の菌を
画線塗抹する。37℃で培養。 |
| |
(3) |
約24時間後、菌の増殖とマンニットの分解能を見る。 |
| |
|
(II)レンサ球菌
|
| (1) |
各々のレンサ球菌の溶血パターンを観察する(上記)。
Lancefield の血清型分類はもともと β溶血を示すレンサ球菌を同定するために考案されたものであるが、 α溶血を示すレンサ球菌や非溶血性の連鎖球菌の一部にも群特異的(group-specific)抗原を有するものがあり、Lancefield の分類に含まれる (D群など)。ヒトの感染症では A, B, C, D, G 群のレンサ球菌の分離頻度が高い。
|
| |
| 群(血清型) |
菌種(例) |
溶血性 |
病原性その他 |
| A |
S. pyogenes |
β |
化膿性炎症、scarlet fever
リウマチ熱 など |
| B |
S. agalactiae |
β |
新生児肺炎、新生児髄膜炎 |
| C |
S. equisimilis |
β |
咽頭炎、心内膜炎、骨髄炎 |
| D |
enterococcal species
(Enterococcus faecalis) |
α,γ |
尿路感染、胆道感染、心内膜炎 |
| |
nonenterococci
(S. bovis など) |
α,γ |
心内膜炎(GI 腫瘍に合併) |
|
G |
S. anginosus |
α |
cellulitis、骨関節感染 |
|
cf. (−) |
S. pneumoniae |
α |
肺炎 |
|
| |
|
| (2) |
バシトラシンテスト(班単位) |
| |
β溶血を示すレンサ球菌についてバシトラシン(抗生物質)感受性を見る。陽性(後述)ならΑ群レンサ球菌と判定される。血清学的な検査との一致率は95%以上であるという。 |
| |
[操作] |
|
| |
- 新しい血液寒天の裏にマジックで線を引き、A群、A群以外と記入。班名も書いておくこと。
- 配られた血液寒天からA群β‐hemolytic streptococcus (S. pyogenes) を白金耳で釣菌し、A群と書かれた半分に塗り付ける。約60°平板を回転させ、同じ白金耳(または滅菌綿棒)で画線する。もう一度60°平板を回転させ同じ白金耳(または同じ綿棒)で画線して菌を平板の半分に一様に広げる。
- A群以外と書かれた半分にも、同じようにしてA群以外のβ‐hemolytic strept. を塗り広げる。
- ピンセットをバーナーで滅菌して、冷やしてからバシトラシンディスクを取り、
平板上の各々の菌の上に置く。軽くディスクを圧迫し寒天表面に固定する。
- 蓋を戻し、蓋を上にして37℃で培養。
- 翌日、阻止円の径を測定しφ18mm以上を陽性とする。14mm以下ならA群以外と判定し、15ー17mmの時は、他の試験を行って総合的に判断する。
|
| |
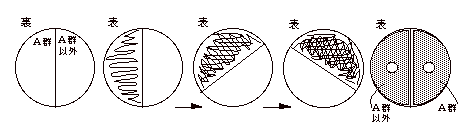
|
| (3) |
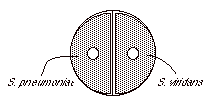
オプトヒンテスト(班単位) |
| |
α溶血を示すレンサ球菌も、オプトヒンディスクを用いて(2)と同様にしてオプトヒン感受性試験を行う。感受性があれば S. pneumoniae 無ければそれ以外というふうに分ける。判定は、バシトラシンの場合に準じる。 |
| |
|
| |
|
【C−4】グラム陰性かん菌の同定(腸内細菌及びビブリオ)(班単位)
ここでは、腸内細菌*及びビブリオを用いて菌の同定の実際を実習する。渡される菌を検体の便とみなせば、検体の選択培地への接種→非選択培地→鑑別培地という流れは、検査室でルーチンに行われているものである。選択培地には非病原菌の増殖を抑える薬剤が含まれており、病原菌の採取が容易となる。赤痢菌、サルモネラ菌(Shigella and Salmonella)に適したSS寒天、DHL寒天、ビブリオに適したTCBS寒天などを用いる。
|
| |
*分類学上の腸内細菌科(Enterobacteriaceae)とは、腸の中にいる菌と同義ではない。 |
| |
|
[準備]
〈第1日〉 |
| (1) |
A, B, C, D, E, F, G
の菌を、班の数+予備、準備する。A 〜 F は普通斜面培地。 G は液体培養したものを混ぜる。 |
| (2) |
SS、DHL、TCBS それぞれ7枚/班。 |
| |
|
| 〈第2日〉 |
| (1) |
BTB平板、6枚/班。 |
| (2) |
3 % NaCl 加BTB平板(赤線入り)、1枚/班。 |
| |
|
| 〈第3日〉 |
| (1) |
LIM 6本、 TSI 7本/班。 |
| (2) |
3 % NaCl 加 LIM (赤線入り)、1本/班。 |
| (3) |
無塩ペプトン水( 1 % Bactopeptone) 2本/班。 |
| (4) |
有塩ペプトン水(赤線入り; 1 % Bactopeptone, 3 % NaCl) 2本/班。 |
| (5) |
普通寒天斜面、6本/班。 |
| (6) |
3 % NaCl 加普通寒天斜面、1本/班。 |
| (7) |
エンテロチューブ等のキット類。 |
| |
|
| 〈第4日〉 |
| (1) |
オキシダーゼテスト用ペーパー、7枚/班。 |
| (2) |
スライド凝集反応の準備。 |
| (3) |
コバックの試薬:パラジメチルベンツアルデヒド 5 g
アミルアルコール(またはイソアミルアルコール) 75 ml
濃塩酸 25 ml |
| (4) |
キット類の判定表 |
| |
|
[操作]
〈第1日〉選択培地 |
| (1) |
A, B, C, D, E, F, G
とラベルのついた菌が配られる。A 〜 F の各々には純培養の菌が1種類、G には2種類混ぜていれてある。A 〜 G
から無菌的に釣菌し、各々をSS、DHL、TCBS、の3種類の選択培地にうえる。班名と菌の種類を記入して37℃で培養する。 |
| |
| 〈第2日〉非選択培地 |
| (1) |
今回の実習では G
以外の菌は純培養である。実際の検体では、選択培地の上に病原菌以外にも colony ができるし、colony
の無い部分でも菌の生育が抑えられて見えないだけで、菌がいると考えた方がよい。目的の菌(病原菌)を釣菌する際には、平板の寒天に触れないようにし、非選択培地に移す。この操作により単一の菌が取れたかどうか確認するわけである。G
では病原菌と思われる colony を非選択培地に移す。C の菌は通常の培地の食塩濃度(0.5 %)では生育しにくい。そのため C の菌だけは
3 % NaCl に調製した培地(赤線入り)を用いる。 |
| |
|
A, B, D, E, F, G → BTB平板へ
C → 3 % NaCl 加BTB平板(赤線入り)へ |
| (2) |
班名と菌の種類を記入して37℃で培養する。 |
| |
|
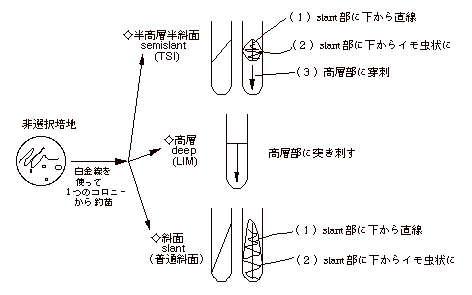
| 〈第3日〉鑑別培地 |
| 目的の菌を非選択培地から鑑別培地へ移す。非選択培地上で単離された colony を白金線で取りTSI, LIM に下図のようにして移す。この際、以下の点に特に注意する。 |
| (1) |
C の菌は、キャップに赤線(3 % NaCl)の入った LIM を使うこと。
TSIは通気性を保つためキャップをゆるくしめて37℃で培養する。 |
| (2) |
TCBSによくはえる C
の菌は、小試に入った無塩ペプトン水(無印)及び有塩ペプトン水(3 %NaCl:赤線入り)にも菌をうえる。D の菌も同様に無塩及び有塩ペプトン水にうえる。 |
| (3) |
各班に6本の普通寒天斜面培地と1本の 3 % NaCl 加普通寒天斜面培地(赤線入り)が配られている。
A, B, D, E, F, G の菌を普通寒天斜面に、C の菌を 3 % NaCl 加普通寒天斜面にうえておく。班名と菌の種類を書いて37℃で培養。翌日オキシダーゼテスト、スライド凝集反応に用いる。 |
| (4) |
同定キットの説明書を読んで、キットにも菌を接種する。 |
| |
|
| 〈第4日〉判定 |
| (1) |
TSI, LIM 等の鑑別培地の判定には、培養時間が critical である(Why?)。
通常18〜24時間で判定する。 |
| |
◆TSI(斜面部および高層部の赤変、黄変により糖の分解能を見る。また、H2S ガス産 生を見る。) |
| |
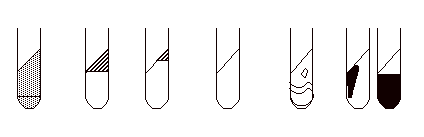
|
| 斜面部の色: |
もとの培地色 |
赤 |
一部のみ赤 |
黄 |
|
|
| 高層部の色: |
もとの培地色 |
黄 |
黄 |
黄 |
|
|
| |
|
|
|
|
|
|
| 判定 |
Glu 発酵 - |
Glu + |
Glu + |
Glu + |
Gas + |
H2S + |
| |
|
Lac - |
Lac, Suc |
Lac + |
|
|
| |
|
Suc - |
一方が+ |
Suc + |
|
|
| |
|
|
一方が -
叉は、過増殖 |
|
|
|
|
| |
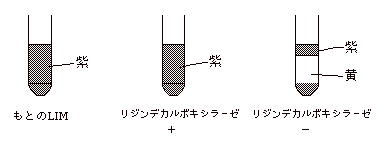
◆ LIM(リジンデカルボキシラーゼ、運動性、インドール産生について見る。) |
|
1. |
リジンデカルボキシラーゼ: H2N(CH2)4CHNH2・COOH → H2N(CH2)5NH2 + CO2 |
| |
 |
|
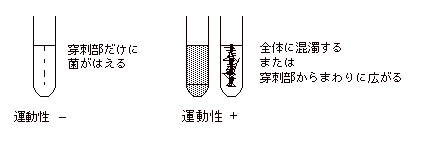
2. |
運動性 |
| |
 |
|
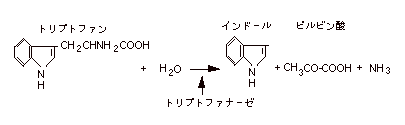
3. |
インドール反応:(1)(2)を見てからコバックの試薬を数滴スポイトで加える。
赤く呈色すれば陽性。
|
| |
 |
| |
オキシダーゼテスト用綿棒に普通寒天から釣菌し、菌をつける。1分以内に濃青色を呈したものを陽性とする。釣菌にニクロム線の白金耳(!)を用いると、擬陽性反応が出る。 |
| |
キット類を判定する。必要な試薬は指示された場所でとる。 |
| |
以上から
- A 〜 F の菌、 G については2つの菌の SS,DHL,TCBS上の colony の所見を記せ。
- A 〜 F の菌、 G の病原菌と判断したものにつき、TSI, LIM 等の所見および チトクロームオキシダーゼの結果を記せ。
- 下の性状表から推定される菌名を記せ。
- キットによる同定結果を用紙に記入しスタッフに提出せよ。
|
| |
|
| |
| (1) |
TSI で Lac- Suc- の菌で斜面部が赤くなるのはなぜか。 |
| (2) |
LIM
でリジンデカルボキシラーゼ陰性の菌でも上部は紫色なのはなぜか。
|
| 使用菌の性状 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Lysine |
|
ペプトン水 |
|
Lac |
Suc |
H2S |
Gas |
decar. |
Indole |
Motility |
無塩 |
有塩 |
| Shigella sonnei |
|
-* |
- |
- |
- |
- |
d(-) |
- |
|
| Salmonella typhimurium |
- |
- |
+ |
+(弱) |
+ |
- |
d(+) |
|
|
| E.coli |
d(+) |
d(-) |
- |
(+)(弱) |
+(弱) |
+ |
d(-) |
|
|
| Citrobacter freundii |
+ |
d(+) |
+ |
+ |
- |
d(-) |
+ |
|
|
| Vibrio parahaemolyticus |
- |
- |
- |
- |
+ |
+ |
+ |
- |
+++ |
| Vibrio cholerae non-O1 |
- |
d(+) |
- |
- |
+ |
+ |
+ |
+ |
++ |
|
| |
+ → 陽性、 − → 陰性、 d → 菌株で異なる。
*Shigella のうちで sonnei は Lac を遅分解 |
| |
|
【C−5】市販鶏肉からのサルモネラの分離(班単位)
Salmonella の分離を試みる。各グループ毎に、鶏ミンチ肉(できるだけ新鮮なもの)を持ってくる (1 〜 2 g でよい)。店により汚染度が異なるので各グループ毎に異なる店で購入することが望ましい。 臨床検体(下痢便等)でも、直接選択培地にうえると同時に、増菌培養を行う。ここで用いる Selenite Brilliant Green (SBG) 培地はサルモネラの増菌に適した選択増菌培地である。 |
| |
|
[準備]
〈第1日〉 |
| (1) |
トリ肉(1 - 2 g)、各班ごと持参。 |
| (2) |
SBG培地、約40 ml を50 ml
のプラスティックチューブに入れ1本/班。 |
| |
|
| 〈第2日〉 |
| (1) |
MLCB(Mannitol Lysine Crystal vilet Brilliant Green)寒天培地、1枚/班。 |
| |
|
| 〈第3日〉 |
| (1) |
TSI 寒天、1本/班。 |
| |
|
[操作]
〈第1日〉(増菌培養) |
| |
ニワトリミンチ肉約 1 〜 2 g を約 40 ml の Selenite brilliant green (SBG) 培地にうえ、
42℃(37℃)一夜培養する。蓋はゆるめておく。 |
| |
|
| 〈第2日〉(分離培養) |
| |
SBG培地から1白金耳をMLCB培地に分離培養する。Colony isolation の要領で画線する。37℃一夜培養。 |
| |
|
| 〈第3日〉 |
| |
本来は、ここで一旦非選択培地に移すことが望ましいが、日数の関係で、なるべくよく分離されたSalmonella の疑いのある colony を選んで鑑別培地(TSI)に移し37℃で培養する。Salmonella は、中心部黒色の中等大の集落を作る。手元にあるキットを用いるのもよい。 |
| |
|
| 〈第4日〉 |
| |
TSI 寒天の性状またはキットによる判定が Salmonella となったものについて抗血清によるスライド凝集反応を行う。 |
| |
|
【C−6】抗生物質感受性テスト(班単位):一濃度ディスク法について実習する。
|
| [準備] |
| (1) |
平板に培養した菌株。2種類(S. epidermidis, P. aeruginosa)/班。各班で分離され たブドウ球菌。 |
| (2) |
普通寒天平板、3枚/班。 |
| (3) |
McFarland 濁度標準液、0.5、1、2、各1本/班。 |
| |
|
| |
|
No. |
0.5 |
1 |
2 |
3 |
.....
|
| 0.36 N H2SO4 (1 % V/V) |
99.5 |
99 |
98 |
97 |
|
| 0.048 M BaCl2 (1.175 % W/V) |
0.5 |
1 |
2 |
3 |
|
|
| (4) |
菌を懸濁するための生食、1本/班。 |
| (5) |
滅菌綿棒 |
| (6) |
抗生物質ディスク |
| (7) |
空小試、3本 |
| (8) |
スポイト |
| (9) |
白金耳、ピンセット |
| |
|
[操作]
〈第1日〉 |
| (1) |
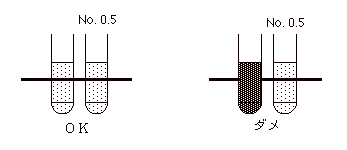
3種類の菌が平板に純培養で配られる。そのうち1つは各班で班員から分離されたブドウ球菌である。空の小試験管3本に生食を約 1 ml
入れ、その中にそれぞれの菌を別々に懸濁し、マクファーランド標準液の No. 0.5
に濁度を合わせる。濁度を比べる場合、白い紙にマジックで線を引き、標準液と菌液の入った試験管を通して、線の見え方を比べるとよい。菌液ができたら15分以内に、綿棒を菌液に浸す。試験管の内壁に軽く押しつけ2〜3回まわして過剰の菌液を除く。各々の菌液を培地に均一に塗布する。平板を60°まわして同様に塗抹。もう一回。 |
| |
 |
| (2) |
ディスクを置く前に、培地表面の過剰の水分を吸収させるためにシャーレに蓋をして、そのまま3〜5分(15分以下)放置。 |
| (3) |
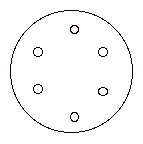
バーナーで滅菌後冷やしたピンセットでディスクをつまみ、菌をまいた平板の上に置く。フチから 2 cm
程離れるよう6枚のディスクを、六角形の頂点の位置に置く。各々の菌について同じ操作を行う。ディスクをめり込まない程度に押しつけ、蓋を上にして37℃で培養。 |
| |
 |
| |
|
| 〈第2日〉 |
| (1) |
各菌において、各抗生物質の阻止円の直径を計り、感受性を判定する。 |
| |
|
【C−7】キット類
菌の同定その他の目的で、種々のキット類が出回っている。その中から、実際に臨床で使用されているもの、これから使用されそうな物を選んで実習する。年々変化するものもあるので、説明は実習講義で行う。
【C−8】細菌に対する消毒剤の効果
感染抵抗性が減弱した患者さんが入院している病室の前には、手の消毒剤が置いてあることが多い。この様な消毒剤を過信して良いものであろうか。ここでは、消毒剤に対する感受性は菌によって異なることを観察し、消毒剤への注意を喚起することを目的とする。 |
| |
|
| [準備] |
| (1) |
黄色ブドウ球菌菌液(一夜培養液を生理的食塩水で10倍希釈したもの)、2〜3 ml/小試/班。 |
| (2) |
緑膿菌菌液(一夜培養液を生理的食塩水で10倍希釈したもの)、3
ml/小試/班。 |
| (3) |
1%ヒビテン、3 ml/小試/班。 |
| (4) |
1%オスバン、3 ml/小試/班。 |
| (5) |
滅菌水、12 ml/チューブ/班。 |
| (6) |
滅菌空小試験管、14本/班。 |
| (7) |
普通寒天プレート、14枚/班。 |
| (8) |
滅菌スポイト(1ml) |
| (9) |
滅菌綿棒、15本/班。 |
| |
|
| [操作] |
| (1) |
消毒剤の希釈
- 滅菌スポイトを用いて、10本の小試に 1 ml ずつ滅菌水を入れる。
- このうち2本に1%ヒビテン 0.1 ml を加えて 0.1 %ヒビテン液を作る。スポイ トの内容を何度も出し入れして、よく混和した後同じスポイトで 0.1 %ヒビ テン液を 0.1 ml 吸い別の滅菌水を入れた2本の滅菌小試各々に加えて 0.01 % ヒビテン液を作る。
- 同様に 0.1 %、0.01 %オスバン液を作る。
- 1%ヒビテン、1%オスバンを各々2本の滅菌空小試に1 ml ずつ入れる。
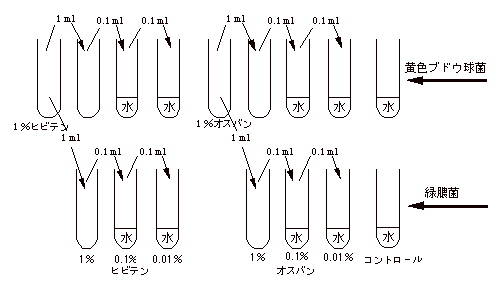
以上により、用意した小試は |
| |
|
| 1ml 滅菌水 |
2本 |
|
|
| 1ml 0.01 % ヒビテン |
2本 |
1ml 0.01 % オスバン |
2本 |
| 1ml 0.1 % ヒビテン |
2本 |
1ml 0.1 % オスバン |
2本 |
| 1ml 1 % ヒビテン |
2本 |
1ml 1 % オスバン |
2本 |
| |
|
|
|
|
|
|
| (2) |
配られた黄色ブドウ球菌菌液に綿棒を浸す。その綿棒を管壁に軽く押し付けることによって過剰の菌液を絞ってから、滅菌水を入れた小試1本に入れる。同様にしして黄色ブドウ球菌菌液をつけた綿棒を、先に階段希釈したヒビテン、オスバン各々に1本ずつ入れる。即ち黄色ブドウ球菌菌液のついた綿棒が7本、小試に立ったはずである。ここで約5分間室温放置。 |
| (3) |
緑膿菌についても同様に行ない、約5分間室温放置。 |
| (4) |
普通寒天プレートに班名、菌名、消毒剤名、消毒剤濃度を記入する。約5分経過後、綿棒を管壁で軽く絞ってから、プレートを回しながら全面に塗り付ける。37℃で一晩培養する。 |
| (5) |
翌日、各プレ−トを観察し、菌数を数えスケッチするなどしておくこと。結果を実習書のうしろの結果表にまとめる。(p.48) |
| |
参考: |
効能書きによると使用濃度は次のようである。
|
| |
|
| |
器具消毒 |
皮膚消毒 |
その他 |
| ヒビテン |
0.1〜0.5 % |
0.1〜0.5 % |
0.05 % |
| オスバン |
0.05〜0.1 % |
0.05〜0.1 % |
0.05 % |
|
【C−9】トイレットペーパーの微生物防御に対する有効性試験および通過細菌に対する手洗いの実験
|
| [準備] |
| (1) |
普通寒天プレート、人数分。 |
| (2) |
MacConkey-Lac プレート(黒色の線)、人数分。 |
| (3) |
大腸菌一夜培養液、人数分小試に分注。400 μl/小試。 |
| (4) |
トイレットペーパー、1個/班。 |
| (5) |
菌液を捨てる容器、1個/班。 |
| |
|
| [操作] |
| (1) |
大腸菌を含む液体培地を、普通寒天プレートの上にその表面が被われるように注ぎ、2〜3分待って過剰の菌液をティシューで吸い取り可燃ゴミに捨てる。これがお尻のモデルである。 |
| (2) |
指にトイレットペーパーを誰が何巻き巻くか、各班で各自に割り当てる(1枚ではまず確実に悲惨なことになるが、良く手を洗えば心配することはない)。割り当ての枚数で指をくるみ、菌をまいた普通寒天プレートの表面をおさえる。 |
| (3) |
トイレットペーパーを可燃ゴミとして捨てる。 |
| (4) |
汚染した可能性のある指を MacConkey-Lac プレートの半分に押し付ける(力を入れすぎるとプレートが割れるので注意)。 |
| (5) |
指を良く洗い、紙タオルでふく。 |
| (6) |
MacConkey-Lac
プレートの残りの半分に(4)と同じ様に指を押し付ける。 |
| (7) |
37℃で一晩培養する。 |
| (8) |
結果を実習書のうしろの結果表にまとめる。 |
| |
|
|
【C−10】A SYNTHETIC EPIDEMIC(レッドハンドは誰だ?)
グループの中に犯人が一人いる。何も知らずに握手したあなたは........????? |
| |
|
|
| [準備] |
| |
クラスを4班に分けて実習するので、1班約25名で構成される。そこで1〜28までの番号をつけた滅菌空小試を4セット用意する。 |
| |
大腸菌 WA3200 一夜培養液(L-broth) 50
ml/flask、1 flask。実習当日、なるべく直前に一夜培養液に等量の滅菌40%グルコースを加える(粘度を与えるため)。
番号をつけた滅菌小試を用意しておき、250 μl の菌液を入れ、そこに綿棒を入れる。蓋はかけない。 |
| |
Serratia marcescens (ILD5218) 一夜培養液(L-broth) 5 ml/中試、1本。
P2の Monod 用シェーカーで培養する(遮光必要)。セラチア一夜培養液を、セラチア一夜培養液:大腸菌一夜培養液:Lブロス=1:1:3で混ぜる。この希釈菌液に等量の滅菌40%グルコースを加える。番号をつけた滅菌小試を用意しておき、250 μl の菌液を入れ、そこに綿棒を入れる(各班1人分)。蓋はかけない。 |
| (4) |
滅菌綿棒、人数分+α。αは第1ラウンドの人だけなので各グループ当り4〜6本程度。 計130本位。 |
| (5) |
BTB寒天培地、人数分+α。αは第1ラウンドの人だけなので各グループ当り 4〜6枚程度。計130枚位。 |
| (6) |
蛍光灯。 |
| (7) |
地下の恒温室のスイッチを入れておく。 |
| (8) |
Mサイズのプラスチック手袋(TAKASHOWのプラスチック手袋がよい)、人数分。 |
| (9) |
綿棒を浸すための滅菌生食、班の数程度。 |
| |
|
|
[実際]
<第1ラウンド> |
| (1) |
1〜4班、5〜8班、9〜12班、13〜15班で各々グループを作る。
各グループの名簿順の最後の者は書記となり、実験には加わらず誰が誰と握手したかを正確に記録する。 |
| (2) |
書記を除く各人は、左手にプラスチック手袋をはめる。手袋をした手であまり物に触らないこと。 |
| (3) |
各グループに番号のついたチューブ入りの綿棒(菌がつけてある)が配られる。各グループで名簿順に#1から順に1本ずつ取る。合図にしたがって、チューブから綿棒を取り出し、★菌液★のついた綿の部分を手袋をした左手掌によく塗り付ける。プレ−トを扱ったりするので左手の指先には菌をつけないこと。チューブは机の上に置いたままとし、綿棒は可燃ゴミに捨てる。 |
| |
★菌液★ |
この実験に用いている菌は大腸菌とセラチアである。傷口などでは感染することもあるので充分注意して取り扱うこと。 |
| (4) |
合図にしたがって、まず#1の人が同一グループの誰かと(書記を除く)と手袋をした左手同士で握手する。この際なるべくすぐ隣の人を選ばず、誰かの所まで歩いていって握手をし、自分の所に戻る。続いて#2の人が誰かの所へ行って握手をし、自分の所へ戻る。この様にして最後の番号の人が誰かと握手をするまで順に握手をしていく。同一人が何人から握手されてもよい。書記は誰が誰と握手したかを記録する。 |
| (5) |
第1ラウンドの握手が終了したところで、各グループの#5、#10、#15、 #20(人数の多いグループでは#25、#30の人も)の人は、新しい滅菌綿棒を取り(菌のついた綿棒ではない!)、用意された滅菌生食で綿棒を湿らせる。それから自分の左手掌をぬぐい、BTB寒天平板の隅に塗り付けておく。手袋ははずさない。綿棒及び袋を可燃ゴミ入れに捨てる。平板の裏に自分のグループ名・番号(氏名でも可)、第1ラウンドであることを書いておく。平板は裏返しのままにしておく。 |
| |
|
| <第2ラウンド> |
| (6) |
(4)の様にして#1の人から順に第2ラウンドの握手を行なう。書記は再び誰と誰が握手したかを記録する。第2ラウンドの握手がすべて終了したら、各人は新しい滅菌綿棒を取り、用意された滅菌生食で綿棒を湿らせ、それから自分の左手掌をぬぐう。その綿棒を各自寒天平板の隅に塗り付ける。第1ラウンド終了時に菌を塗った#5、#10....の人も、第2ラウンド終了時には新しい綿棒を使うこと。塗り終わった綿棒と袋は可燃ゴミに捨てる。 |
| (7) |
手袋を不燃ゴミに捨ててから、各自白金耳を用いて寒天の隅に塗った菌からコロニー分離をするように画線培養する。平板に自分のグループ、番号氏名を書いてスタッフまで届ける。 |
| (8) |
スタッフは平板を集め、少し低い温度(〜30℃)で蛍光灯で光を当てながら、一夜培養する。 |
| (9) |
翌日平板上のコロニーをチェックする。セラチアは赤い色を出す。各グループにセラチアを塗った人が一人いるが特定できるか? |
| |
|
【C−11】野菜の実験
野菜の常在細菌について実習する。 |
| |
|
| [準備] |
| (1) |
大腸菌または黄色ブドウ球菌、一夜培養液。Lブロスで約10倍希釈して各班 0.5 ml 位ずつアルミキャップの滅菌小試に分注。1本/班。 |
| (2) |
普通寒天培地 3〜4枚/班。 |
| (3) |
滅菌綿棒。2〜3本/班。 |
| (4) |
各班で野菜を用意する。 |
| (5) |
安全剃刀 1〜2枚/班。 |
| |
|
| [操作] |
| (1) |
各般の有志が野菜を用意する(1〜2種類、各1ケ)。ミニトマトなどがお勧めであるが、この時期値段も高いので、カキ、タマネギ、ブドウ、バナナ、など何でも良い。 |
| (2) |
野菜を安全剃刀で切って、普通寒天培地にスタンプする。別の普通寒天培地に配られた菌液を滅菌綿棒で広げ(抗生物質感受性の項参照)、その後から野菜をスタンプする。一夜培養して結果を観察する。
注意:安全剃刀を使用する際には怪我をしないよう注意する。使用した安全 剃刀、未使用の安全剃刀は危険物なので不燃ゴミとして捨てず、スタ ッフにわたす。 |
| |
|
|
【D】動物ウイルスの定量
●インフルエンザウイルスの血球凝集による定量(HA)及び抗体による阻止試験(HI) |
| [準備] |
| |
インフルエンザウイルス2〜3種、各 200 〜300
HA、各500ml/斑。 |
| |
抗インフルエンザウイルス抗体(以下の血清のこと) 約 100
HI、各400ml/斑。 |
| |
トリ新鮮血 1本。 |
| |
各班に
- プラスチックチューブ(15 ml) 2〜3本(8HA 作るためウイルスの 数だけ必要)
- チューブ入り PBS 10 ml(ウイルス希釈用)
- 0.5 % トリ赤血球 10 ml
- ピペット 5 ml 2 本(袋入り)
1 ml 5 本(袋入り)
- チップ 15本
- ピペットマン(p200) 2 本
- 連続ピペッター 1 本
- 連続ピペッター用シリンジ 1=50 μl, 1=25 μl 各 1 本(袋入り)
- 96穴U字プレート 2 枚
- 96穴U字プレート用カバー 2 枚
- 水溶性マジック 1 本
- プラスチック・ビーカー 1 個(シリンジ洗浄用)
- ボトル入りPBS 1 本(シリンジ洗浄用)
|
| |
|
| [操作] |
| (1) |
HA |
|
1. |
配られたウイルス各々につき、2倍階段希釈を作る。 |
| |
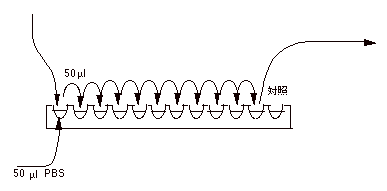
(a) |
下の図の様に96穴マイクロプレートの各穴に連続ピペッターで 50 μl の PBS を加える。 |
| |
(b) |
ウイルス液 50 μl をピペットマンでとり、図の要領で希釈する。 |
| |
|
| 2. |
ニワトリ赤血球(0.5 %)を良く混ぜた後、各穴に 50 μl
を加える |
| 3. |
静置 約60分(30分位で読める)。 |
| 4. |
底から覗くと次のようなパターンが見られる。この例ではHA値は64である。判定の後37℃で30分静置し、変化がないか観察せよ。 |
| |
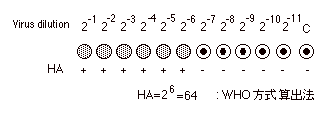
|
| |
|
| (2) |
Back Titration [何故 Back Titration をやるか考えよ] |
|
1. |
上の HA 値から希釈倍数を計算し、8HA のウイルス液を作る。HI にも使うので 2〜3 ml
作る。薄め過ぎるとこの操作をやり直すことになるので注意する。 8HA のウイルス液を作ったら、(1)のやり方で HA 値を確認する。 |
| |
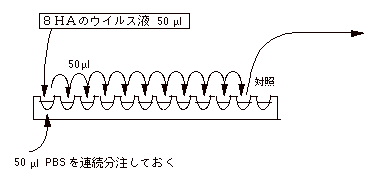
|
| |
結果が下図のようになればOK。 |
| |
|
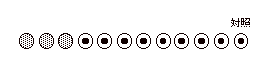 |
| |
|
| (3) |
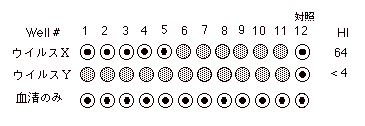
HI |
|
1. |
はじめに各穴に25μl の PBS を連続分注しておく。 |
|
2. |
25μl
の血清をピペットマンでとり、図の要領で希釈する。各血清につき(与えられたウイルスの数+1)系列作る。 |
| |
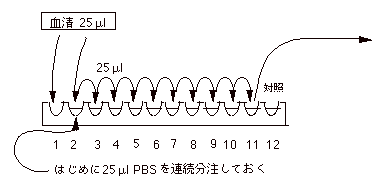
|
|
3. |
8HA のウイルス液を各穴に25μl
ずつ加える。対照の穴には入れない。 |
|
4. |
20分放置。 |
|
5. |
トリ赤血球(0.5 %)50μl
を各穴に加える。約60分後判定。 |
| |
|
| |
|
| |
|
|