 |
 |
(エボラウイルス)
東京大学医科学研究所
感染症国際研究センター
野田岳志特任助手撮影 |
 |
 |
Copyright (C) 2005
The Japanese Society for Virology All rights reserved. |

|
 |
TOP >> ウイルストピックス >> インフルエンザウイルスについて
インフルエンザウイルスについて
|
 |
|
| はじめに |
我が国でも山口県において、79年ぶりに高病原性(強毒型)トリインフルエンザウイルス(A H5N1型)の感染が起こり、SARS(Severe Acute Repiratory Syndrome)と相まって国民の関心がインフルエンザウイルスに向いている。そこで、高校の生物を受講したレベル以上の方がインフルエンザウイルス研究について概括することを目的として、豊田の個人的判断でreviewを行った。また、我が国のウイルス研究者では30歳代の研究者の人材が不足している(「へこんでいる」)と思われる。拙稿が、これを機にimpact factor 100以上を引っさげた研究者がインフルエンザウイルス研究に参入する際にどこを狙えば良いのかを探る一助となれば幸いである。さらにmedical virologyを3日でreviewしたい方は拙著を参照されたい(1)。
A型インフルエンザウイルスは再興感染症として注目されている。インフルエンザウイルスはNPとM1蛋白の抗原性からA型、B型、C型に分類され、A型は鳥類、哺乳類、ヒトに感染する人獣共通感染症であり、B型もアザラシとヒトに感染する人獣共通感染症であるが、C型はヒトにのみ感染する。我国では、小児の脳炎・脳症、老人の肺炎が社会的問題となっている。そして、新型インフルエンザウイルス(A H5N1型ウイルス、A H9N2型ウイルス)の脅威に対し、WHO、CDCを中心とする国際的な監視体制が敷かれ、オランダ、東アジアにおける高病原性(強毒型)トリインフルエンザウイルス(AH5N1型、A H7N7型)の流行と、ヒトへの感染に対して対処を行っている。
|
| ゲノムと粒子構造 |
インフルエンザウイルスはオルソミクソウイルス科に属し、A型、B型は8本、C型は7本の分節型マイナス鎖RNAをゲノムとして持つ(表1)。
|
表1 インフルエンザウイルスのゲノム構造
| ゲノム分節 |
A型 |
B型 |
C型 |
| 1 |
PB2 RNAポリメラーゼ、キャップ結合、宿主域の決定 |
PB2 RNAポリメラーゼ |
PB2 RNAポリメラーゼ |
| 2 |
PB1 RNAポリメラーゼ、RNA合成、キャップ依存性RNA分解、PB1-F2 アポトーシス誘導 |
PB1 RNAポリメラーゼ RNA合成 |
PB1 RNAポリメラーゼ RNA合成 |
| 3 |
PA RNAポリメラーゼ ゲノム複製 プロテアーゼ |
PA RNAポリメラーゼ |
P3 RNAポリメラーゼ |
| 4 |
HA リガンド 赤血球凝集素 膜融合 |
HA リガンド 赤血球凝集素 膜融合 |
HEF リガンド 赤血球凝集素 膜融合 エステラーゼ |
| 5 |
NP RNP ゲノム複製 |
NP RNP |
NP RNP |
| 6 |
NA ノイラミニダーゼ ウイルス粒子の放出 |
NA ノイラミニダーゼ NB 機能不明 |
ない |
| 7(C型は6) |
M1 膜マトリックス M2 イオンチャンネル |
M1 膜マトリックス BM2 イオンチャンネル |
M1 膜マトリックス CM2 機能不明 |
| 8(C型は7) |
NS1 非構造蛋白質 mRNAの核外輸送の阻害 mRNAのスプライスの阻害 NS2 |
NS1 非構造蛋白質
NS2 非構造蛋白質 |
NS1 非構造蛋白質
NS2 非構造蛋白質 |
|
| A型ウイルス粒子の模式図を図1に示した。A型、及びB型インフルエンザウイルスは、宿主細胞膜由来の脂質二重膜よりなる外被(エンベロープ)で囲まれた直径100〜250nmの粒子の中に、NPをとりまく8本の分節型マイナス鎖RNAゲノム(PB2、PB1、PA、HA、NP、NA、M、NS)とウイルスRNAポリメラーゼ(PB2、PB1、PA)からなるRNPが存在する。外被はM1に裏打ちされており、細胞表面のシアル酸をレセプターとするリガンドであるHA糖蛋白、ノイラミニダーゼ活性を持つNA糖蛋白、そして、イオンチャンネルであるM2が存在する(2)。さらに、M1に結合して、少量のNS2(NEP)蛋白が存在する。そして、感染細胞内ではこれら構造蛋白の他にNS1が合成され、合計10種類の蛋白が合成される(一部のA型ウイルスはPB1遺伝子にさらにPB1-F2をコードする)。C型ウイルスは7本の分節ゲノムを持つ。 |
| |
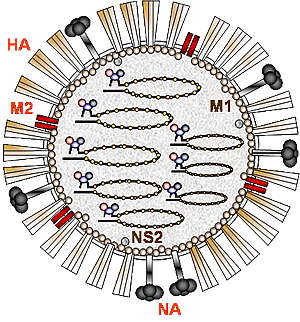
【図1】A型インフルエンザウイルス粒子の模式図
|
|
| 抗原変異と分子進化 |
(53巻1号特集4−3.新型インフルエンザウイルス対策by 喜田 宏)
|
| A型ウイルスには異なる抗原性のHAが15型、NAが9型あり、それらは全て水禽類から分離されており、水禽類がreserverと考えられている。そして、A型ウイルスはこれまでに、4回の世界的大流行をおこしたが、Websterのグループによりそれは中国南部においてトリ型ウイルスとヒト型ウイルスがブタに混合感染し、遺伝子組換え(reassortant)がおこり、新たな抗原(HA、NA遺伝子)を持つウイルスがヒトの間に大流行したということが解明された(antigenic shift、図2、http://www.hokudai.ac.jp/veteri/organization/dis-cont/microbiol/index.html)。 |
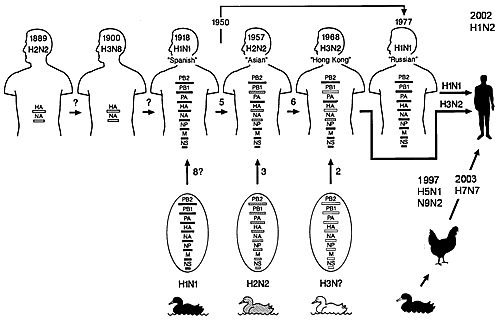
【図2】A型インフルエンザウイルスのantigenic shift
|
血清学的研究から、H2N2とH3N8のウイルスはそれぞれ1889年と1900年に流行したと考えられる。トリ由来のウイルスは1918年以前にヒトとブタに伝播し、1900年に流行していたウイルスに取って代わったと考えられる。この変異ウイルスは、アメリカの軍隊によって北アメリカからヨーロッパへともたらされて、スペイン風邪の大流行となった。1957年には、アジア風邪が流行した。アジア風邪流行後は、H1N1のウイルスは姿を消した。そして、1968年にはホンコン風邪が流行した。ホンコン風邪流行後は、H2N2のアジア風邪を引き起こしたウイルスは姿を消した。1977年には1950年代に流行ったH1N1のウイルスがソ連風邪として再び流行し、若年世代に感染が広がった。
(Knipe, D.M. and Howely P.M. eds. Fields Virology 4th ed., Lippimcott Wiiliams & Wilkins, New York, 2001.より改変)
|
|
1977年のソ連風邪以降は世界的大流行は起こっていないが、A型(H1N1とH3N2)、B型の小流行が毎冬見られる。これまではトリ型ウイルスはレセプターとの親和性の相違からヒトには感染しなかったが、高病原性トリ型ウイルスのヒトへの感染はトリからの直接的な感染であると考えられている。また、A H1N2ウイルスのヒトにおける感染も確認された。
また、HA、NAゲノム自体も抗体による選択圧を受けて、毎年antigenic driftという変異をしている。
HA、NA分子は早くからWiley(http://www.crystal.harvard.edu/Our_Group/Don_C__Wiley/don_c__wiley.html)、Colmanのグループにより立体構造が解明され、その後の構造生物学のモデルとなった(3)。そして、HAはclass
I膜融合のモデルを提供している(4、図3)。
また、H3型HA遺伝子の進化(同義置換)速度は1.41x10-2変異/塩基/年と計算された。
現在流行している高病原性トリインフルエンザウイルスが変異、遺伝子再集合によりヒトからヒトへ直接感染するようになり、ヒトの間で流行するようになることがもっとも危惧されている。
|
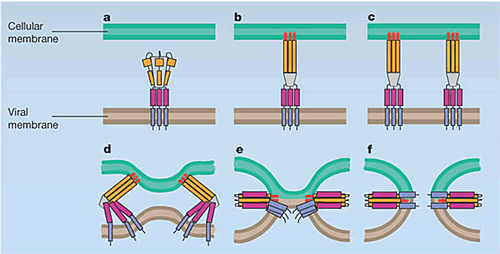
【図3】class I膜融合
|
a. class I融合蛋白質三量体モデル。オレンジ:helical domain A、ピンク:helical domain B、紫:transmembrane domain;b c、 ウイルス外被の糖蛋白質は、感染細胞膜表面のレセプターに結合した後、エンドソーム内のpH低下により、構造が変化して伸展し、疎水性の融合ドメイン(赤)が分子表面に露出し、感染細胞膜に挿入される。この時、HA0→HA1+HA2の開裂が起こっていなければ、融合ドメインは分子表面に露出できない。d、さらに、分子構造が変化して折れ曲がり、ウイルス外被と感染細胞膜が近づき、e、結合する。f、融合ドメインとtransmembrane domainがanti-parallelに再構成し、ウイルス外被と感染細胞膜が融合し、膜融合が完結する。
(Jardetzky, T.S. and Lamb, R.A. A class act. Nature 427: 307-308, 2004.より改変)
|
|
細胞レベルにおける感染・増殖
|
(52巻1号特集4−9.インフルエンザウイルス(感染・遺伝子機能)―インフルエンザウイルスの感染と複製機構の分子論的研究の展開―by 榎並正芳)
A型インフルエンザウイルスは細胞表面のシアル酸を持つ糖蛋白質、糖脂質にHAで結合(吸着)する(図4A、http://w3pharm.u-shizuoka-ken.ac.jp/~biochem/)。吸着したウイルスはクラスリン依存性のendocytosisにより、細胞に取り込まれる。そして、endosomeの酸性化が起こると、HAの構造変化が起こり、ウイルス外皮と細胞膜の融合がおこる。また、endosomeの酸性化はM2イオンチャンネルを活性化し、ウイルス粒子内が酸性化し、RNPがM1から解離して細胞質内に放出される(脱殻)。RNPは核に輸送され、ウイルスゲノムの転写複製が行われる。
|
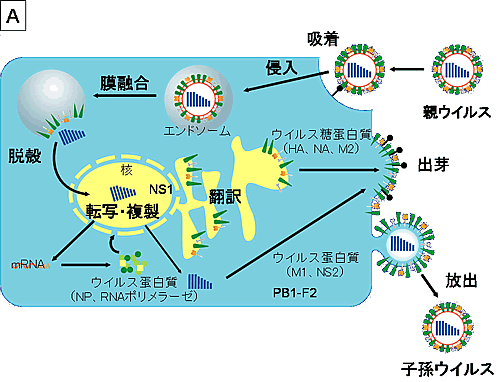
【図4A】A型インフルエンザウイルスの感染細胞における増殖
A型インフルエンザウイルスの細胞への吸着から放出に至る経路(A)と阻害剤の標的部位(B)を図示した。(河岡より改変)
|
病原性
|
| インフルエンザウイルスの感染にはHA→HA1+HA2の開裂による、HA2N末端の疎水性アミノ酸ストレッチ(fusion domain)の露出が必須である(図5)。
|
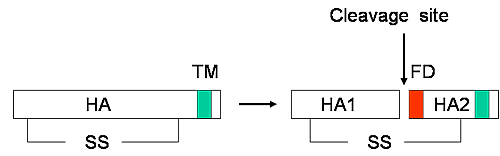
【図5】HA蛋白質の開裂部位
|
前駆体HAはプロテアーゼによりHA1とHA2に開裂し、HA2のN末端の疎水性のアミノ酸ストレッチ(FD: fusion domain)が露出できるようになる。
HA1とHA2はジスルフィド結合(-SS-)により連結している。TM: transmembran domain
|
|
これまでのヒトのウイルスは全て、開裂部位のアミノ酸がmono basicという弱毒型の構造であったが、multi basicの強毒型の構造をもつトリウイルス(H5N1、H7N7、H9N2)のヒトへの直接的感染が起こっている。強毒型のmulti basic構造は細胞内に普遍的に存在するfurin等のプロテアーゼの認識構造であり、強毒型HAは感染細胞膜に輸送されるpost Golgiで開裂をうける。したがって、すべての臓器の細胞において、感染が多段階に進行する。一方、従来のヒトインフルエンザウイルスはその開裂活性化部位がmono basic構造であるため、furinの認識は受けない。このような弱毒型インフルエンザウイルスは前駆体であるHAを持ったウイルス粒子として感染細胞から放出される。もちろん、このウイルスは感染力を持たない。ところが、弱毒型インフルエンザウイルスの標的臓器であるトリの腸や気道ではトリプシン様のプロテアーゼが分泌されており、それによりHA→HA1+HA2の開裂がおこり、ウイルスは感染力を獲得し、感染が多段階に進行する。このようにして、HAが開裂活性化されることで、その臓器における感染が進行し、病原性の発現が行われる。これを、プロテアーゼ依存性ウイルストロピズムという。
スペイン風邪、ホンコンH5N1ウイルスの研究からHA糖蛋白だけでなく、PB2も毒力(種特異性)を決定することが解明された(5)。
|
遺伝子発現
|
| A型インフルエンザウイルス感染細胞核では、ウイルスRNAポリメラーゼにより、転写複製が行われる。インフルエンザウイルスRNAポリメラーゼの研究は石浜、豊田、Krug、Ortín、Brownleeのグループにより行われ、立体構造解明に向けてしのぎを削っている。ウイルスRNAポリメラーゼはPB1、PB2、PAのへテロ三量体で、PB2が宿主細胞mRNAのキャップ構造を認識し、PB1がそれを切断し、プライマーとして転写を開始し、ポリ(A)を付加する(図6)。そして、複製(ゲノム(v)RNA→cRNA→vRNA)はPAが担っている。また、転写複製にはさまざまな宿主因子の関与が報告されている(http://www.md.tsukuba.ac.jp/public/basic-med/infectionbiology/virology/)。
|
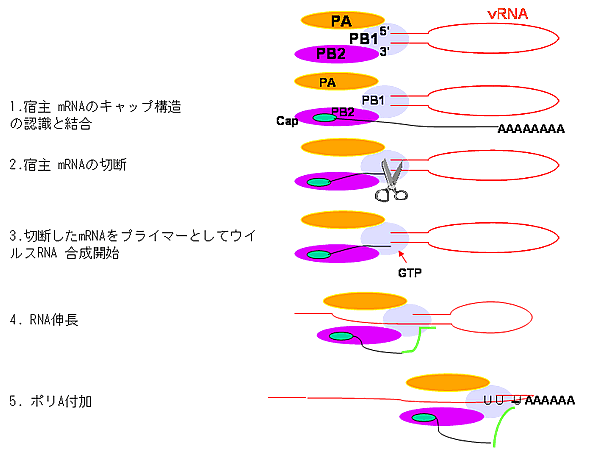
【図6】A型インフルエンザウイルスの遺伝子発現
|
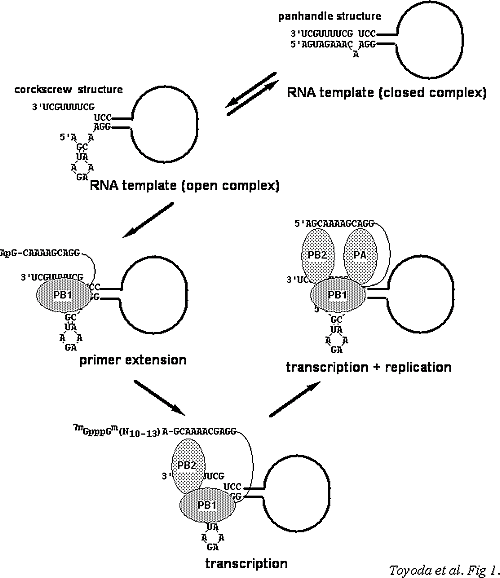
【図7】A型インフルエンザウイルスRNAポリメラーゼヘテロ三量体
|
Reverse genetics
|
(特集2−5.インフルエンザウイルス・ゲノムのパッケージングby 藤井 豊,河岡義裕)
マイナス鎖RNAウイルスのreverse geneticsは遅れたが、まず、PaleseのグループによりRNP transfection法が開発され(6)、その後、河岡(http://www.ims.u-tokyo.ac.jp/virology/firstpage.htm)のグループによりゲノムcDNAから人工的にウイルスを作成するというインフルエンザウイルスの完全なreverse genetics法が開発された。
|
インフルエンザ抵抗因子、抗インフルエンザウイルス薬
|
インフルエンザウイルス抵抗性宿主因子としてインターフェロンにより誘導されるGTPase、Mx蛋白がある(7)。マウスMx1は核に局在し、ヒトMxAは細胞質に局在するが、それらの阻害作用についてはまだ解明されていない。Mxホモログとしてダイナミンがクローニングされた。
抗インフルエンザ薬としてはM2イオンチャンネル阻害薬アマンタジン(8)、リマンタジン、NA阻害薬ザナミビル(GG167)、オセルタミビル(GS4101)が用いられている(図B)。ザナミビルはNAの立体構造からデザインされ、その後の新薬開発のモデルとなった(9)。アマンタジンは1998年に我が国でも抗インフルエンザ薬として認可され、広く使用されるようになったが、耐性ウイルスはすぐに出現した(10)。
|
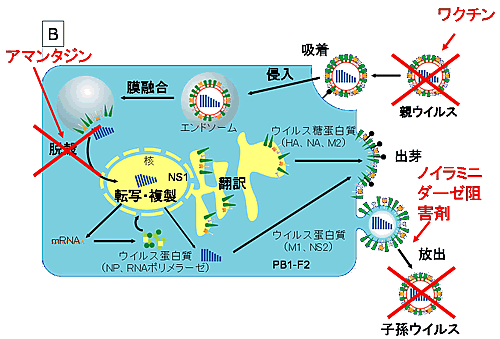
【図4B】A型インフルエンザウイルスの感染細胞における増殖
A型インフルエンザウイルスの細胞への吸着から放出に至る経路(A)と阻害剤の標的部位(B)を図示した。(河岡より改変)
|
インフルエンザの臨床
|
(52巻1号特集1−8.インフルエンザ―最近の臨床の進歩―by 菅谷憲夫)
従来のヒト型インフルエンザウイルス感染は、呼吸器の局所感染の典型であり、突然の高熱を特徴とする。
尚、インフルエンザウイルス脳炎脳症については、標的臓器に「ウイルスの存在しないウイルス病」と考えられ、サイトカインに対する異常な反応という説が提起されている(11)。また、日本小児科学会(http://www.jpeds.or.jp/saisin-j.html)が「インフルエンザ脳炎・脳症における解熱剤の影響について」という提言を出した(2002年11月12日)。
|
おわりに
|
インフルエンザウイルスは冬季に流行する。冬と言えば阪神淡路大震災の記憶があるが、インフルエンザの流行とあのような災害が重複したらどのような事態になるのであろうか?
また、アメリカにおける牛海綿状脳症(BSE)の発症、東アジアにおける高病原性トリインフルエンザウイルスの勃発は単に食料事情の問題として受け取られるかもしれない。もし、これが、エネルギー(石油)の問題として勃発したら我が国はどうなるであろうか?グローバルな研究の展開にも対応できる人材がウイルス研究に参入してくることを期待する。
|

|
文献
|
- 吉倉、豊田編集 ワンポイントウイルス学、南山堂、2001
- Pinto, L.H., Holsinger, L.J., and Lamb, R.A., Influenza virus M2 protein ha ion channel activity. Cell, 69, 517-528, 1992.
- Varghese, J.N., Laver, W.G., and Colman, P.M., Structure of the influenza virus glycoprotein antigen neuraminidase at 2.9 A resolution. Nature 303, 35-40, 1983.
- Jardetzky, T.S. and Lamb, R.A. A class act. Nature 427: 307-308, 2004.
- Hatta, M., Gao, P., Halfmann, P., and Kawaoka, Y. Molecular basis for high virulence of Hong Kong H5N1 influenza A viruses. Science. 293: 1840-2, 2001.
- Luytjes, W., Krystal, M., Enami, M., Parvin, J.D., and Palese, P. Amplification, Expression, and PAckaging of a Foreign Gene by Influenza Virus. Cell, 59, 1107-1113, 1989.
- Haller O, Kochs G. Interferon-induced mx proteins: dynamin-like GTPases with antiviral activity. Traffic. 3: 710-717, 2002.
- Hay, A.J., The action of adamantanamics against influenza A viruses: inhibition of the M2 ion channel protein. Seminars in Virology, 3, 21-30, 1992.
- von Itzstein, M., Wu, W.-Y., Kok, G.B., Pegg, M.S., Dyason, J.C., Jin, B., Phan, T.V., Smythe, M.L., White, H.F., Oliver, S.w., Colman P.M., Varghese, J.N., Ryan, D.M., Woods, J.M., Bethell, R.C., Hotham, V.J., Cameron, J.M., and Penn, C.R., Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature, 363, 418-423, 1994.
- Iwahashi, J., Tsuji, K., Ishibashi, T., Kajiwara, J., Imamura, Y., Mori, R., Hara, K., Kashiwagi, T., Ohtsu, Y., Hamada, N., Maeda, H., Toyoda, M., and Toyoda, T. Isolation of Amantadine-Resistant Influenza A Viruses (H3N2) from Patients Following Administration of Amantadine in Japan. J. Clinic. Microbiol. 39:1652-1653, 2001.
- Morishima T, Togashi T, Yokota S, Okuno Y, Miyazaki C, Tashiro M, Okabe N; Collaborative Study Group on Influenza-Associated Encephalopathy in Japan. Encephalitis and encephalopathy associated with an influenza epidemic in Japan. Clin Infect Dis. 35: 512-517. 2002
|
|
|
|
|
| |
 |
|
 |

