第18章 細菌感染症
|
|
|
|
前の章で述べた様な、感染症の一般的状況を理解しておく事がまず重要である。
ここから、幾つか一般的な細菌感染症を紹介する。病院には、以前に増して抵抗力の弱い患者が増え、結果としてそれ迄病原菌として認められなかったような菌が病気を起こす。それで、病院で出会う菌には教科書で名前も見なかったようなものも出てくる。 |
|
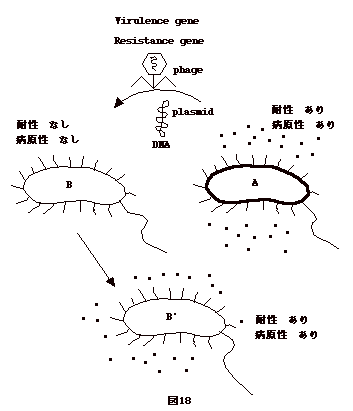
| 時代により、出会う菌はどんどん変る。もう一つ重要な事は、細菌はどんどん性質を変えることが出来るという事である。プラスミド導入、ファージの溶原化、transformation
による DNA
の導入などで病原性や薬剤への感受性はどんどん変わっていく(図18)。 細菌が原因となって病気が起こる場合、細菌の毒素が主役である事が多い。サルモネラに感染したテイラミスによる食中毒、コレラ感染での激しい下痢、破傷風菌感染のテンカン大発作様けいれん、ボツリヌス中毒の弛緩性まひ、いづれも毒素によるものである。
毒素が発病の原因であるならば、必ずしも菌は体の中で増殖しなくてもよい。実際、ぶどう球菌のエンテロトキシン中毒、ボツリヌス中毒などは、食品の中で菌が増殖し毒素を作り、それを人が食べる事で起こる。
体内に菌が入って中毒が起こる場合でも、菌が全身感染を起こさなくともよい。コレラ菌は、腸上皮に接着し、そこで毒素を出す。毒素は上皮細胞の機能のみを阻害し、水分が腸管にどんどん出てしまう。
毒素は、大きく内毒素と外毒素に分けられる。 |
 |
18−1:内毒素
内毒素は、グラム陰性菌の外側のリポ多糖体で、付け根にあるリピドAがその活性を担う。グラム陽性菌には、従って、内毒素は無い(3-4-2参照)。
普通のグラム陰性菌が感染すると、発熱、補体の活性化による炎症症状、マクロファージの活性化、Bリンパ球の活性化など、生体警報機構が活性化される。
特に、大腸菌、緑膿菌、髄膜炎菌などのグラム陰性菌が血液内で増えると(敗血症)、内毒素は血圧低下と血管内血液凝固を主徴とするショック、更に全身性の
D I C (disseminated intra-vascular coagulation ) を引き起こす。
18−2:外毒素
内毒素は糖脂質であるが、外毒素は蛋白質である。それが、菌体外に出される。
蛋白質であると云う事は、毒素蛋白をコードする特別な遺伝子が存在すると云う事である。もし、その遺伝子に変異が起きて毒素活性を失えば、同じ菌でも、その毒素による病原性は失われる。毒素遺伝子がプラスミドに乗っていれば、毒素産生能は菌から菌へ伝達され得るし、プラスミドが脱落すれば毒素非生産菌となる。患者分離菌を長く実験室で培養すると、病原性が失われるのは、プラスミド脱落による場合が多い。
蛋白であるので、特異的抗体によりその活性を抑える事が出来る。つまり、抗毒素により、発病を阻止する事が出来る。破傷風、ボツリヌス、ジフテリアの抗血清療法はその代表である。しかし、例えば破傷風の場合、毒素が神経細胞に取り付いてしまった後では無効である。標的細胞に毒素が達しない内に十分な抗血清を投与しなければならない。素早い対応が必要である。患者をたらいまわしにすると、それだけで医療上の罪になる。 |
|
| 抗血清は血流内に投与するので、毒素が血管になければ無効である。コレラは腸管に留まり毒素を出すので、IgA
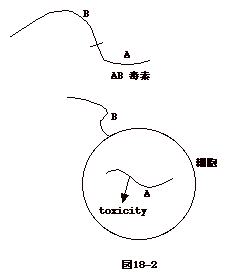
のような腸管に分泌される抗体でないと無効な筈である。因みに、従来使用されてきたコレラ予防注射はあまり効果が無い。 細胞内に入ってから作用を発揮するジフテリア毒素や、破傷風毒素、ボツリヌス毒素等は、AB毒素と云われる構造を持つものが多い。細胞のレセプターに結合するB(binding)
フラグメントと毒素活性を持つ A(active)
フラグメントの2つのフラグメントからなる。ジフテリア毒素の場合、毒素が細胞に入るとAB両フラグメントに蛋白分解酵素で切断され、Aフラグメントが細胞内で毒素活性を発揮する。こうして、レセプターのある標的細胞だけを確実に攻撃する事が出来る。AB毒素は多くの場合標的蛋白を
ADP ribosylation し細胞障害を起こす(図18-2)。 |
 |
18−3:細菌と宿主細胞との相互作用
18-3-1:細胞内増殖と細胞外増殖
細菌は、宿主の体内での宿主細胞との相互作用の様式に於て大きく2つに分けられる。一つは、宿主の細胞内で増殖し、細胞に障害を与える場合、もう一つは宿主の細胞外で増殖し、産生する毒素により細胞を障害する場合である。
細胞の中でしか増殖出来ない菌としては、
クラミジア(Chlamydia、おうむ熱、性器クラミジア
症、新生児肺炎等の病原体)
コクシエラ(Coxiella burnetti, Q熱の病原体)
リケッチア(Rickettsia prowazekki, 発疹チフスの病原 体)
貪食細胞に入り増殖する菌としては
レジオネラ (Legionella pneumopila、在郷軍人病)
マイコバクテリア(Mycobacterium tuberculosis、結 核菌、M. lepraeらい菌)
ノカルジア(Nocardia、肺感染症を起こす)
非貪食細胞に入り増殖する菌としては
バルトネラ(Bartonella、ネコ引っ掻き病病原体)
ブルセラ(Burucella)
ツラレミア病原体(Francisella tularensis)
リステリア(Lysteria monocytogenes)
サルモネラ(Salmonella)
赤痢菌(Shigella)
などがある。
一方細胞外で増殖する菌としては次のような菌がある。
内、胞子形成をしないものとして、
百日咳菌(Bordetella pertussis)
ボレリア(Borrelia)などの螺旋菌
キャンピロバクター(Campylobacter)
ジフテリア菌(Corynebacterium diphtheriae)
大腸菌(Escherichia coli)
インフルエンザ菌(Haemophilus influenzae,
H. ducreyi)
ヘリコバクター(Helicobacter pylori胃潰瘍を起こす)
肺炎桿菌(Klebsiella pneumoniae)
レプトスピラ(Leptospira interrogans)
マイコプラスマ(Mycoplasma)
ナイセリア(Neisseria meningitidis, N. gonorrheae)
緑膿菌(psuedomonasu aeruginosa)
ぶどう球菌(Staphylococci)
連鎖球菌(Streptococci)
コレラ菌(Vibrio cholerae)
ペスト菌の仲間(Yersinia pestis, Y. enterocolitica, Y. psuedotuberculosis)
内、胞子を作るものとしては、
炭疽菌(Bacillus anthracis)
破傷風、ボツリヌス、ガス壊疽菌(Clostridium tetrani, C. botulinum, C.
perfringens)
などがある。
寄生虫も宿主細胞と色々な相互作用をする。アメーバ赤痢を起こすEntamoeba
histolyticaは粘膜上皮の上あるいは上皮内で増殖し、腸管粘膜に潰瘍を作る。鞭毛の無いamastigote期のレイシュマニア(Leishmania)は貪食細胞内にいる。マラリア原虫は赤血球に感染する。トキソプラスマ(Toxiplasma)は宿主細胞内でしか増殖出来ない。又、眠り病を起こすトリパノソマ(Trypanosoma
cruzi)は、昆虫では細胞外で増えるが脊椎動物では細胞内で増殖する。
カビの仲間のヒストプラスマ(Histoplasma capsulatum)はマクロファージ内のphagolysosomeで増殖する。又、HIV感染で肺炎の原因となるPneumocystis
cariniは表面の糖蛋白とfibronectinを介し肺胞細胞と密着して増殖する。
18-3-2:細菌の宿主細胞への接着
細菌は生体に侵入すると、まず宿主細胞に接着する。接着に関わる細菌側の構造の代表として、先ず、グラム陰性菌のfimbriaeが挙げられる。大腸菌の内、腎盂腎炎を起こす菌にはP線毛(P
pili)があり、宿主の上部尿路細胞表面にあるα-D-galactopyranosyl-(1-4)-β-D-galactopyranosideに結合する。つまり、菌のP線毛と宿主の特定の分子が結合することにより細菌は宿主細胞に特異的に接着する訳である。
しかし、全ての細菌の接着がfimbriaeによる訳ではない。淋菌や髄膜炎菌の属するNeisseriaでは、菌のOpa蛋白が宿主の癌胎児抗原(carcinoembryonic
antigen)と結合することにより接着が起こる。
ペスト菌の属するYersiniaは特有のadhesinであるinvasinが宿主細胞のβ1-integrin
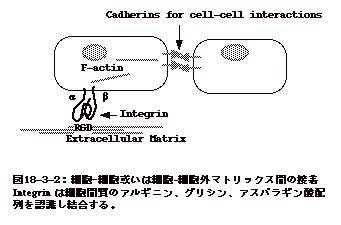
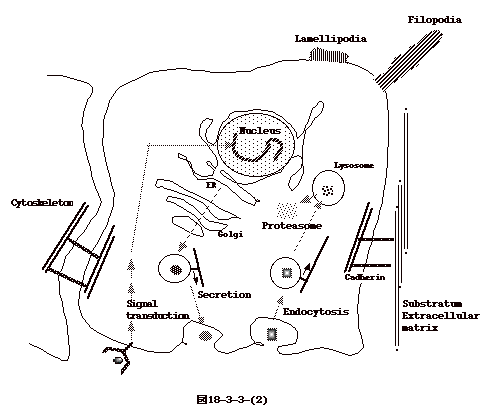
familyのfibronectin受容体に結合することにより接着が起こる。らい菌は神経シュワン細胞に特異性を示すが、宿主由来のlamininが菌と宿主のβ4-integrinを架橋する事による。ここで出てくるintegrinは、図18-3-2
に示すように、細胞が細胞間質(extracellular matrix)との接着に使用する分子種である。同じ図にあるcadherinは、上皮細胞では外側及び側面に発現し、基底側には発現しない。基本的には、細胞同士の接着に関与する。後に述べるように、E-cadherinは赤痢菌が一つの細胞から隣の細胞に感染するのに関与する。E-cadherin欠損細胞では細胞から細胞への感染が上手くいかない。又、Listeria
monocytogenesが細胞に侵入する際、菌側の侵入に関与するInternalin A
(InlA)の受容体はE-cadherinである。
細菌によっては、細胞に接着するとその状態で毒素を出し細胞に障害を与えたり(例、コレラ菌)、宿主細胞の中に侵入する。 |
|
 |
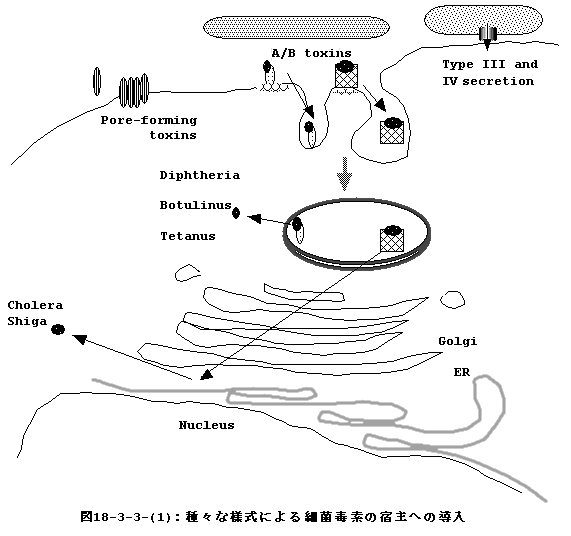
18-3-3:細菌毒素
細菌毒素は、宿主細胞を攻撃するメカニズムの違いにより4種類に分ける事が出来る。即ち、(1)細胞表面のレセプターへの結合自体によるもの(surface-acting
toxins)、(2)細胞表面に孔を開けるもの(pore-forming toxins)、(3)AB毒素(A/B
toxins)、及び(4)III型及IV型分泌系によるもの(Type III and IV secretion)である(図18-3-3-(1))。最後の(4)に属する毒素は、細菌が宿主細胞と直接接触し宿主細胞に侵入したりするのに関与する。いわゆる毒素ではないので、細菌の宿主細胞への侵入増殖の項で扱う。 |
|
 |
(1)細胞表面のレセプターへの結合自体によるもの
Staphylococcus aureusのtoxic shock syndrome toxin (TSST-1)やStreptococcus
pyogenesのsuperantigen A等はいわゆるsuperantigenと云われるものである。superantigenはMHCII(組織適合抗原II)とT
cell receptor (TCR)に結合し両者を架橋する。この為大量のT細胞が活性化され、ショック症状を起こす(参照19-1-1-(1))。この場合の細胞のレセプターはMHCIIとTCRと云うことになる。
(2)細胞表面に孔を開けるもの
赤血球に作用させると溶血が起こるので、hemolysin(溶血素)と云われる事がある。細胞の表面で溶血素蛋白が環状に重合すると、環の真ん中に孔が出来、細胞膜に孔があくことになる。
孔のサイズにより2種類に分けられる。孔のサイズはどうやって決まるのだろう。それは、重合する溶血素蛋白の数に制限が有るか無いかで決まる。
S. pyogenesのStreptolysin Oは、コレステロールを含有する細胞膜に結合しそこで際限なく重合を続けるので、孔の径もどんどん大きくなる(35nm)。結果、高分子のものも細胞膜を素通りするようになる。S.
aureusのα毒素の場合には重合が7個(heptamer)に止まり、径も1nm位の小さい孔を作る。従って、カルシウムなどの電解質は素通りするが蛋白質は通過できない。
(3)AB毒素
A(acitive、活性)領域、B( binding、結合)領域からなる。A領域は細胞質にある標的分子に作用し毒性を発揮する領域であり、B領域はA領域を運搬する役割を果たす。細胞の毒素受容体を認識し結合するのは、B領域である。A領域の活性様式で、種々に分けられる。
1)蛋白合成阻害
ジフテリア毒素(DT)のA領域は、蛋白翻訳伸長因子EF2のanti-codon認識部位に近接した715番目のアミノ酸histidineを特異的にADP-ribosyl化し、ペプチド伸長を止める。B領域はR(receptor
binding)とT(transmembrane)領域とに分けられるが、R領域が細胞のheparin-binding
epidermal growth factor-like precursorを受容体として細胞にくっ付き、疎水性のT領域が構造変化し細胞膜に突き刺さりA領域を細胞質に移行させる。
赤痢菌の志賀毒素のA領域はN-glycosidase活性を持ち、28SリボソームRNAのアデニン残基を一つ切り出しその機能を失わせる。結果翻訳伸長因子(EF1、EF2)と相互作用出来なくなり蛋白合成は抑えられる。B領域の細胞側受容体は、globotriasylceramideである。
2)G蛋白の修飾
コレラ毒素(CT)、毒素原性大腸菌(enteropathogenic E. coli)のLT-I、LT-IIは、何れも、ADP-ribosyltransferase活性を持つ。GTPと結合した状態の時のみasdenyl
cyclase(cAMP合成酵素)を刺激するGs蛋白が、CTによりADP-ribosyl化されると、Gs蛋白固有のGTPase活性が消失し、GTP結合Gsが恒常的にadenyl
cyclaseを刺激することとなる。
百日咳毒素(PT)もADP-ribosyl化活性を持つが、基質はadenyle cyclaseを抑制するGiである。adenyl
cyclaseは恒常的に活性化される。
CTの受容体はganglioside GM1、LTはその他のgalactose含有分子(glycosphingolipids等)、PTはN-acetylglucosamineの付いた分枝mannoseコアを糖とする糖蛋白である。
3)Adenylate Cyclase
B. pertussisの177.7kDa蛋白は、N末端にcalmodulin依存性adenylate
cyclase領域を有し、C末端のhemolytic領域を介して細胞内に導入されると、cAMP合成を盛んに行う。B.
persussisの持つもう一つの毒素、百日咳毒素(PT)は抑制的に働くGiの活性化を抑えcAMP合成を恒常的に上げる(前項参照)。よって百日咳菌はcAMPレベルを上げる為の2種類の機構を持つ事になる。
4)細胞燐酸化酵素の不活化
炭疽防御抗原(Anthrax protective antigen)は3つの蛋白、protective
antigen (PA)、edema factor (EF)、lethal factor (LF)の複合体である。まず、PAが細胞表面のレセプターに結合すると、N末端の20kDaが切断除去される。すると別に分泌されていたEFとLFの複合体がPAに結合しendocytosisを経て細胞に取り込まれる。LFは細胞増殖やシグナル伝達に重要な燐酸化カスケードの主役であるMAPKK(mitogen
activated protein kinase)を切断し不活化する。一方、PAの方は、細胞表面で構造変化し、真ん中に孔のある集合体を作り細胞表面に孔をあける。
5)細胞内物質輸送の阻害
細胞は、レセプターを介した物質の取込み(receptor-mediated
endocytosis)をしたり、ERで出来た蛋白質をGolgiを経て特別な小胞体(vesicle)により分泌したりしている。つまり細胞内には物質輸送路がある(図18-3-3-(2))。このような輸送経路を破壊する毒素がある。その代表が破傷風、ボツリヌス毒素である。 |
|
 |
| 神経細胞はシナプスを介して刺激を伝達している。シナプスの前(つまり刺激を伝達する側)の細胞をpresynaptic
cellと云う。presynaptic cellは神経伝達物質(neurotransmitter)をシナプスに分泌し、後方の神経細胞に刺激を伝える。分泌には、神経伝達物質の入った小胞体がシナプス側の細胞膜に上手くドッキングし膜融合する必要がある。このプロセスに必要なのがVAMP/Synaptobrevinである。
破傷風菌毒素もボツリヌス毒素もSynaptobrevinをこわす。しかし起こす症状は違う。これは毒素が入っていく細胞が異なるからである。
破傷風毒素は神経筋接合(neuromuscular junction)で神経細胞に侵入し、逆行性に脊髄まで輸送される。そこで、運動神経細胞と抑制神経細胞とが作るシナプスに放出され、更に抑制神経細胞内に入る。抑制神経からのneurotranmitter分泌が出来なくなるので硬直性麻痺が起こる。ボトリヌス毒素の方は神経筋接合で運動神経細胞に入るので弛緩性麻痺を起こす事となる。
18-3-4:細胞内で増殖する細菌
細菌の感染を受けると、生体防御の為、好中球やマクロファージが感染部位に動員され、細菌をどんどん食べて消化してしまう。しかし、もし細菌がこれらの細胞の中で消化されずに増殖し続ける事が出来れば、細菌は抗体等の影響も受けずに、むしろ安心して増殖出来る訳である。細菌の中にはこのような戦略をとるものがある。
18-3-1項で示したように、細菌が侵入する細胞は、マクロファージに限らず非貪食細胞の場合もある。非貪食細胞は、本来、物を取り込まないので、菌としては何とかして細胞に入り込むトリックを考えなければならない。
侵入の様式として、次の3つがある。即ち、(1)細胞の貪食(phagocytosis)によるもの、(2)細胞に食菌現象を誘導し取り込まれるもの(induced
endocytosis/phagocytosis)、(3)細菌が積極的に侵入するもの(active invasion)である。
又、小胞体に取り込まれた状態で細胞に入った場合、小胞体がlysosomeと融合するとlysosome内の酵素により菌は消化される恐れがある。これをどうやって避けるかが問題となる。その機構として、(1)小胞体がlysosomeと融合するのを妨げる、(2)小胞体を消化し細胞質に抜け出す、と云う2つの機構がある。
細菌では能動的に侵入する例(active invasion)は無いが、Toxoplasma、Plasmodium等の寄生虫はzoiteと呼ばれる発生段階で自分自身の運動性により細胞に侵入し、小胞体で増殖する(activeな侵入であることは、cytochalacin
Dと云うmicrofilamentに毒性のある物質に抵抗性の宿主細胞とzoiteを用い証明出来る。実験方法を考えて見よう)。面白いことに、active
invasionではなく、zoiteを抗体にまぶし宿主細胞表面のFc受容体を介した受動的な様式で細胞内に入れてやると小胞体のpHが下がり虫は死んでしまう。activeに細胞に入る事が細胞内での生残に関係していると云う事になる。
18-3-5:細菌の宿主細胞への侵入
細菌の宿主細胞への侵入機構は次のように分類することが出来る。
(1)非貪食細胞に於けるジッパー機構による侵入
Listeria monocytogenesは、菌体表面に発現しているinternalin A
(InlA)と細胞表面のE-cadherinとが順次結合する事により細胞に取り込まれる(図18-3-5-(1)上、図18-3-2参照)。菌が、菌体上の抗体と細胞表面の抗体レセプターとの結合を利用して食菌される(図16-6参照)のと良く似ている。この場合、細胞がジッパーを閉じるような動きをする為、細胞骨格が激しく変化し、チロシンやリピドの燐酸化酵素が活性化される。
Yersiniaもジッパー機構を使って細胞に侵入する。この場合は菌体表面のinvasinと細胞のintegrin(細胞-細胞外マトリックスの接着に関与)の結合による。何れの場合も細胞が他の細胞あるいは構築物と接着する機構を細菌は上手く利用している訳である。
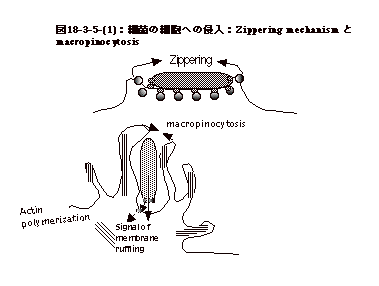
(2)細菌の取込みを細胞に誘導することによる侵入
普通には貪食作用の無い細胞に細菌が働きかけ、細菌が細胞に侵入してしまう機構である。細菌の出す毒素がtype
IIIの分泌系を使い細胞に注入されると一連のシグナル伝達が起こり、結果、急激なactin
filamentの重合により細胞は盛んに偽足のようなものを出して周りの物を取り込む。これをmacropinocytosisと云う(図18-3-5-(1)下)。 |
|
 |
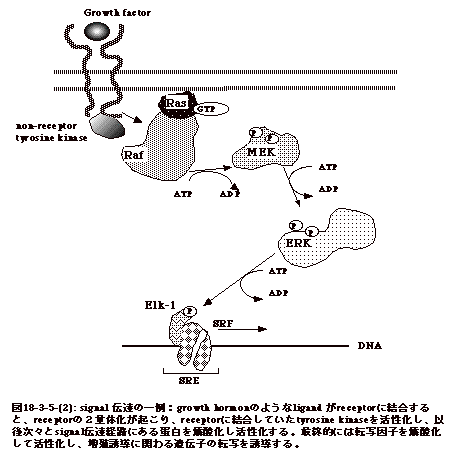
(註)シグナル伝達
動物細胞は、隣の細胞同士、或いはホルモン等に反応し、遺伝子の発現を調節している。反応を受け取るのは細胞表面であるので、受け取られたシグナルは遺伝子発現の場である核へ届けられなければならない。これがシグナル伝達(signal
transduction)である。シグナルは、伝達経路にある蛋白が次々と伝達経路下流の蛋白を燐酸化し活性化する事で伝わっていく(図18-3-5-(2)。
しかし、複数ある伝達経路の間で、どうして燐酸化に於ける混線が起こらないのだろうか。又、どのような機構により複数の蛋白を次々と効率よく燐酸化して行くのであろうか。一つの機構は燐酸化蛋白と燐酸化される蛋白の間の酵素ー基質特異性である。もう一つは、伝達経路に関わる複数の蛋白の足場を作り蛋白同士反応しやすくする蛋白(scaffold
protein)の存在である。当然、そこには蛋白ー蛋白の結合には特異性がある筈である。 |
|
 |
| 赤痢菌(Shigella)のmacropinocytosis 場合、ipa及びMxi-spaの遺伝子が関係する。typeIII(18-3-7参照)の分泌系はMxi-spa遺伝子産物が担い、注入される毒素はipa産物(Ipa)である。Ipaの細胞側レセプターはintegrinと推定されている。
赤痢菌が細胞に侵入する時、細胞が膜状のひらひらを出すがそこにはactin
とactinを束ねるfimbrin がある。fimbrinのdominant negative変異蛋白を発現している細胞には赤痢菌は侵入できなくなるので、fimbrinが菌の細胞侵入に重要な働きをしていることが分かる。
(註)dominant negativeとは、ある変異蛋白を細胞に発現させると正常な蛋白が発現していても、正常な蛋白の機能が無くなる現象を云う。蛋白同士が重合し機能を発揮するような場合、変異蛋白があると正常な蛋白だけの重合体が出来ない場合などがその例である。
このような赤痢菌細胞侵入の際のactin再構成を司るシグナル伝達には、低分子GTPaseであるRho蛋白が関係する。低分子GTPase群(Rho、Rac、Cdc42)は増殖因子刺激によりactin細胞骨格の再構成を起こし、種々のシグナル伝達の分子スイッチの役割を果たす蛋白である。Rho以外にc-Srcも関係する。c-Srcは、赤痢菌の侵入時に燐酸化され活性化し、cortactinを燐酸化する。cortactinはactinを多く含む細胞偽足に運ばれる。
このように、細菌は宿主細胞の機能を上手く利用し細胞に侵入していることが分かる。細菌はむやみに細胞に押し入るのではなく、宿主細胞本来の性質を上手く利用し宿主に感染する訳である。
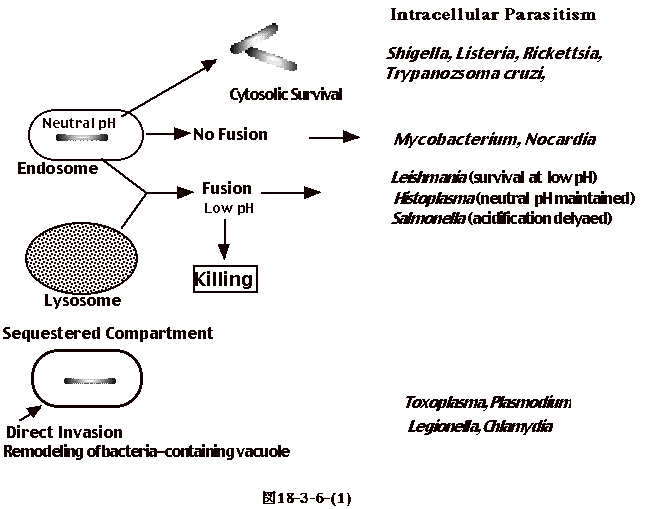
18-3-6:細菌の細胞内生残の機構
細菌は小胞体の中に取り込まれた形で細胞に侵入する。小胞体はlysosomeと融合し(phagolysosomeと呼ばれる)、中のpHが下がると消化酵素が細菌を消化する(消化酵素は酸性条件下でのみ活性がある)。
この場合病原体が逃れる方法として次のような様式がある(図18-3-6-(1)参照)。 |
|
|
(1)phagolysosomeの中で平気で増殖するもの
寄生虫の仲間に入るLeishmaniaは、マクロファージに貪食されても酸性環境のphagolysosomeの中で消化されない。恐らく、細胞内のamastigoteの細胞表面がlipidoglycanで被われ消化され難くなっている為と思われる。Histoplasmaでは、何らかの機構によりphagolysosomeの酸性化が抑えられ、宿主の消化酵素が働かない。
(2)細菌が小胞体とlysosomeとの融合を阻害する場合
結核菌等のMycobacteriumの入った小胞体はlysosomeと融合しない。結核菌の細胞壁リピドcord
factorに小胞体とlysosomeの融合を妨げる作用がある為である。但し、融合しないと云っても絶対的なものではなく、融合した場合でもphagolysosome内部の酸性化が抑えられる機構もMycobacteriumの細胞内生残に関与しているようである。実際、phagolysosomeのpHを下げるのに重要な働きをするプロトンATPaseは、結核菌が入っるとそのphagolysosomeでは活性が低くなる。
Chlamydia、Legionella、Toxiplasma、Plasmodium、Cryptosporidium等は宿主の膜輸送系から完全に独立した(sequestered)小胞体コンパートメントに入る。Legionellaはcoiling
phagocytosisと云われる奇妙な食菌のされかたをするが、この菌を含む小胞体は、ERを取り込みribosomeが沢山突き刺さった膜を持つ様になる。又、Chlamydiaを含む小胞体はinclusion
body(封入体)に形を変える。このように、小胞体自体が普通の小胞体とは違ったものに変わり、結果としてlysosomeと融合する経路から外れてしまう。
(3)宿主細胞の細胞質に逃れる場合
Shigella、Listeria、Rickettsia、寄生虫のTrypanosoma cruziは、小胞体の膜を破壊し、細胞質に出て運動し増殖する。
Listeriaの病原性にはlisteriolysin O (LLO)が関与している。菌が小胞体から細胞質に逃げ出すにはLLOのみで十分であるが、その他に2種類の
phospholipase Cが関与している。ShigellaについてはLLOのような特定の酵素は見つかっていない。 細胞質に出た菌はそこで増殖し更に周りの細胞に感染する。その為には細胞質の中で動き回り、隣の細胞に侵入しなければならない。細胞質は、蛋白、RNA、細胞内小器官等でギッシリ詰まっている訳であるから菌がいくら鞭毛などをふりまわして泥んこの中でもがくようなもので到底動けない。そこで菌は、またもや宿主細胞の機能を上手く利用することをしている。それはacitinの重合である。
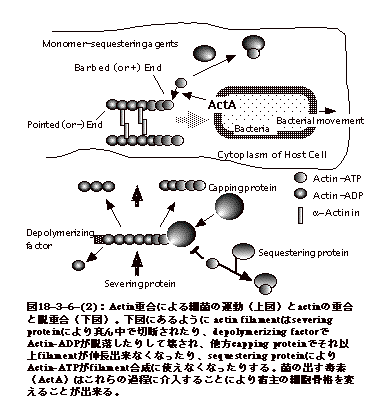
(4)細菌による細胞骨格の再編
細胞の中のactin filamentはactinが図18-3-6-(2)のように重合したものである。actin-ATPがfilamentの片方(barbed
end又は+endと云う)からくっ付き長くなる。他方、反対側(pointed
end又は- end)からADP-actinが外れる。従って、filamentは全体としてbarbed
endの方に移動することとなる(図18-3-6-(2))。
ListeriaのActA蛋白はactin filamentを菌体表面に集合させ、barbed
endが菌体側に来る様に整列させる。するとactin重合が起これば自然に菌はfilamentと反対側に押しやられ、結果として菌は動き廻る。
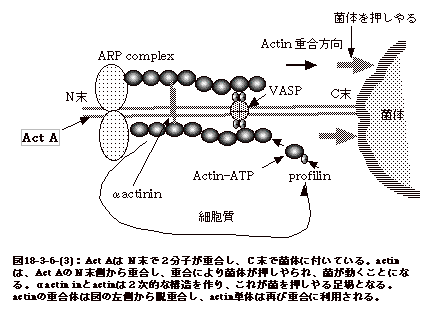
actin重合には、actin-ATPの他、ARP、4量体として機能するVASP、単量体actinと結合するprofilin、が必要である。ActA蛋白はC端で菌体に付き、その特別な領域でARP蛋白を介しactin
filamentと結合し、その部位よりもC端に近いもう一つ別の領域でVASPと結合する。profilinと結合したactinは、VASPに結合しそこで重合が起こると云うモデルが出されている(図18-3-6-(3))。要するに、菌の運動方向と反対側に局在するActAが、そこにactin
filament 重合に必要なARPやVASPをリクルートする訳である。
| |
 |
| 赤痢菌の場合はIcsA蛋白がListgeriaのActAとおなじような働きをするがアミノ酸配列には相互の類似性(homology)はない。恐らく、別の蛋白から出発し同じ機能を持つに至ったので、このような現象をconvergent
evolutionと云う。
菌の細胞間移動については解析が十分進んでいないが、赤痢菌の場合、宿主細胞がE-cadherinを欠くと移動が悪くなることが報告されている。
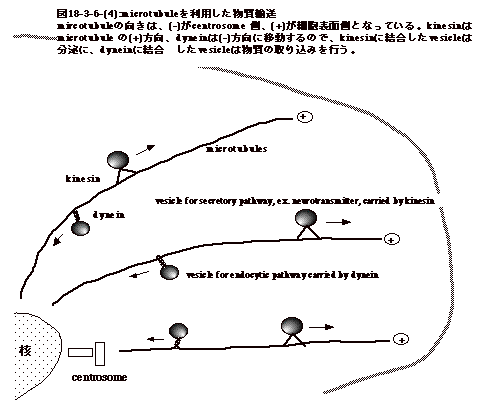
(註)Microtubule
真核細胞には細胞骨格(cytoskeleton)がある。actinは細胞骨格分子の一つであり、他にmyosin,
intermediate filament, keratin、microtubule等がある。この内、microtubuleは種々の細胞内構造物の細胞内移行に関係する。
静止期の細胞では、microtubuleは核の側にあるcentrosomeから辺縁部に放射状に伸びている。microtubuleには方向性があり、重合速度の早い(+)極と遅い(−)極がある。(+)極は常に辺縁部側にある。
物質移動に関係するkinesinとdyneinの2種の分子(motor protein)があり、kinesinは(−)極から(+)極へ、dyneinは(+)極から(−)極へ移動する。取り込み経路(endocytic
pathway)に入る物質はdyneinに付いたvesicleに、分泌経路(secretory pathway)に入る物質はkinesinに付いたvesicleに取り込まれ、分泌される(図18-3-6-(4))。
| |
 |
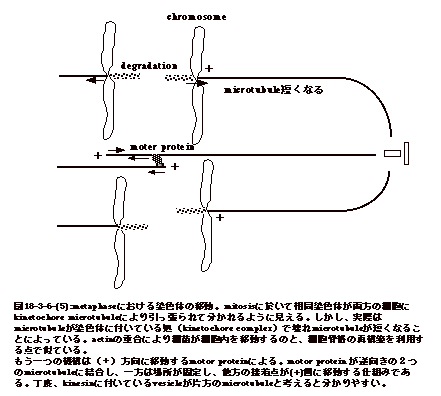
| 細胞分裂期では、microtubuleは染色体のkinetochoreに結合し恰も染色体を細胞の両極に引っ張っているように見える。実際は、microtubuleの(+)極が染色体にくっ付き、そこでmicrotubuleが壊れmicrotubuleが短くなり、結果として両極にあるそれぞれのcentorsomeに近付く。actinの重合で細菌が前に押しやられ移動するのと、逆のような現象である。しかし、microtubuleが短くなっただけでは両極がお互いに引き寄せられてしまう。そこで、染色体に付着しない相互に逆向きのmicrotubuleが突っ張り合う。これにはmicrotubule上を(−)方向に移動するmotor
proteinが関係し、逆向きのmicrotubuleの(+)極付近に結合し固定されると、motor
proteinの移動に伴いmicrotubule同士はお互いに離れる。このmotor proteinは(−)方向にmicrotubule上を動く点dyneinに似ている(図18-3-6-(5))。 |
|
 |
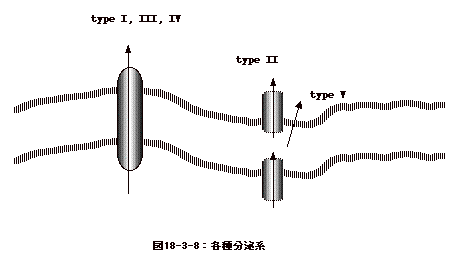
18-3-7:Type III及びType IV分泌系
グラム陰性細菌には、種々の蛋白分泌系がある。Type I 、TypeIII、Type
IVでは、内膜、外膜を通したワンステップで分泌が起こる。従って、Type
IIやType Vの分泌系に見られるような分泌蛋白にシグナル配列はない。他方、Type
IIとType Vでは、内膜外膜2つのステップに分かれ、N末のシグナル配列が内膜を通った段階で切断除去される。Type
IIとType Vの違いは、前者ではシグナル配列を失った蛋白が次の膜輸送蛋白複合系を使って分泌されるのに対し、Type
Vでは蛋白は外膜を直接すり抜けC末が外膜に残る(図18-3-8参照)。
(1)Type III分泌系
Type IとType IIIとは一見似ているが内容は可成り異なる。 Type Iは比較的単純な構造で、輸送エネルギーを供給するATPase、periplasmを貫通する蛋白、外膜に位置する蛋白の3つからなる。分泌される毒素は大腸菌の溶血毒等であるが、C末にType
I分泌系により認識される領域がある。
Type IIIは鞭毛に近い複雑な構造をしている(図18-3-7-(1))。鞭毛伸長の際、subunitの重合は鞭毛の先端で起こるので、subunitは鞭毛の中を通って先端に運ばれるわけであるから、この機構を利用していると考えればよい。分泌蛋白はそのN末にType
III分泌系に認識される為のシグナル配列を持っている。 |
|
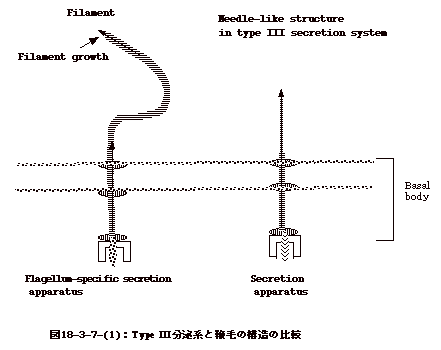 |
| Yersiniaは、細胞外で増殖する菌である。従って、食菌を抑えるシグナルを細胞に送る必要がある。このシグナルを担うのがYopH、YopE蛋白で、Type
III分泌系により細胞に送り込まれ、食菌に際し起こる細胞の形態変化を抑える。YopHは脱燐酸化酵素で、宿主の細胞外マトリックスとの接着に重要な役割を果たすfocal
adhesion complexの形成制御に関係するp134casやfocal adhesion kinase
を脱燐酸化する。
YopHは真核細胞のtyrosine phosphataseと共通したアミノ酸配列を持っている。又、植物病原体Xanthomonas
campestrisのType III分泌蛋白AvrBs3は真核細胞でしか必要のない核局在シグナル領域を持っている。他のType
III分泌蛋白にも真核細胞特有の配列が見つかっており、細菌がType
III分泌蛋白の遺伝子を真核細胞から「拾って来た」のではないかと云われている。
図18-3-7-(2)に病原性大腸菌(EnteropathogenicE.coli)のType
III分泌系を示してある。 |
|
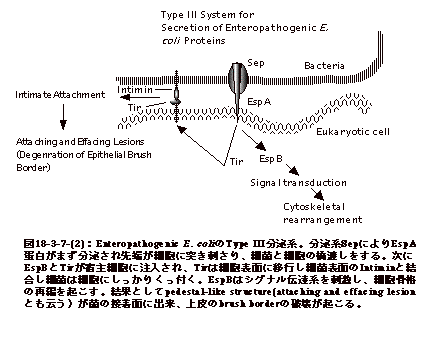 |
(2)Type IV分泌系
Type IV分泌系はAgrobacterium tumefaciensが植物細胞にcrown gallを作るT-DNAを注入する系で代表される(図18-3-7-(3))。遺伝子構造は伝達性プラスミドのTra
operonに似ている。プラスミドDNAが伝達される訳であるが、認識されているのはDNAに結合している蛋白であり、DNAはそれに引きずられて移行すると考えられている。T-DNAはそのコードするVirD2/VirE2と複合体を作り伝達されるが、single
stranded DNA binding protein (SSB)であるVirE2のみでも伝達が起こる。胃潰瘍(胃がんも?)の原因となるH.
pyloriの40kbに及ぶ病原性に関係する領域cagはTra operonと構造が似ており、アミノ酸配列の似た蛋白が存在する。Cagは宿主に炎症を誘導するIL-8産生を高める何らかの物質を注入している。但し、DNAを伝達出来るかどうかは分かっていない。 |
|
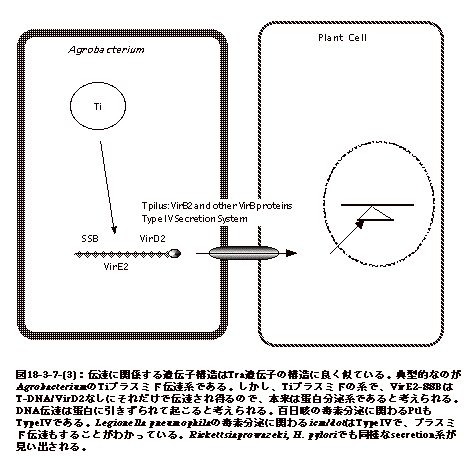 |
(3) 植物病原細菌
Psuedomonas 属やXanthomonas
属の一部の細菌は植物に病気を起こす。菌は、細胞内apoplast(細胞質外に相当)で増殖するが、先ず、type
III分泌蛋白と相同性の高い遺伝子が誘導される。動物細胞への感染の場合と似た働きをするのではないかと考えられている(但し、動物細胞への感染に用いられる針にあたる部分に相同性のある蛋白は見つかっていない)。Psuedomonasはヒトの日和見病原体であり、植物動物両方に病気を起こすことを考えると興味深い。又、最近、Agrobacteriumがtype
IV分泌系を利用して動物細胞へ遺伝子を導入することが、in vitroで示された。
このように動物への感染と植物への感染に共通点が見つかりつつあることは、非常に興味深い。又、動物で自然抵抗性に関係するToll様受容体が、植物の抵抗性に関わっていることが明らかになりつつある(Science
292, 2285-2289, 2001)。
18-3-8:分泌系
この項では、分泌系一般についてもう一度概説する。分泌系にはtype Iからtype
V 迄ある。
上に述べたように、この内、type IIIとtype IV
が細菌が宿主細胞と相互作用し、細胞に取り込まれる際に使われる(19-3-7)。即ち、細菌は、これらの分泌系を利用し、宿主細胞に毒素蛋白を注入し、細胞のシグナル伝達系などを介して、菌の取り込みを誘導する。
type I、type III、type IV分泌系においては、分泌蛋白は、細胞膜から外膜迄貫通する輸送系(transporter)により、一段階で分泌される。type
I分泌系で分泌される蛋白にはC末に分泌シグナル配列があるが、type
IIやVの場合のようにシグナル配列が切り離されることはない。type
I分泌系により分泌される毒素には、大腸菌のhemolysin、百日咳菌のcyclolysinなどがある。type
IIIとtype IVについては上述した通りである。
一方、type IIとtype V分泌系では、分泌は2段階となっている。細胞膜のみを貫通するtransporterによりperiplasmに迄輸送され、その際、N末に分泌シグナルアミノ酸配列が切り離される。その後、type
IIでは蛋白複合体からなる別の輸送系を介し更に菌体外に分泌される。一方、type
Vでは分泌蛋白の分泌後切り離されるC末のアミノ酸配列を介し、特別な輸送系を介することなく分泌される。線毛(pilus)は菌体外で会合するが、構成蛋白(pilin)の分泌は
、鞭毛の場合とは異なりtype
II分泌系による。type V による分泌としては、Helicobacter pyloriのvacuolating
cytotoxinがある。 |
|
 |
|
|
|