第16章 感染と生体防御
|
|
|
|
16−1:感染論
さまざまな細菌が、さまざまな病気を起こす。これを、どの様に整理して、考えればよいか。微生物の感染による発病迄の過程は次の6つのステップに分けて考える事が出来る。
1.菌と出会う
2.菌が侵入する
3.菌が体内で広がる
4.菌が増殖する
5.菌が組織を障害する
6.発病
それぞれのステップにおいて、宿主は菌に対して防御機構を持っている。菌は防御機構を乗り越え次のステップに進もうとする。宿主の防御機構がそれぞれのステップで菌に打ち勝てなかった場合にのみ宿主は発病する。HIV(エイズウイルス)に感染すると、体の免疫機構が崩壊する。すると、免疫状態が正常な人では発病に至らないような細菌やウイルスの感染でも発病に至る。一方赤痢菌や腸チフス菌は元気な人でも感染し、発病させる。これは、菌が上の幾つかのステップに於て、宿主の防御機構をどんどん乗り越えて行ける性質を持つ為である。各論では、この様な細菌の性質を理解する事が大切である。
16−2:病原体の自然史
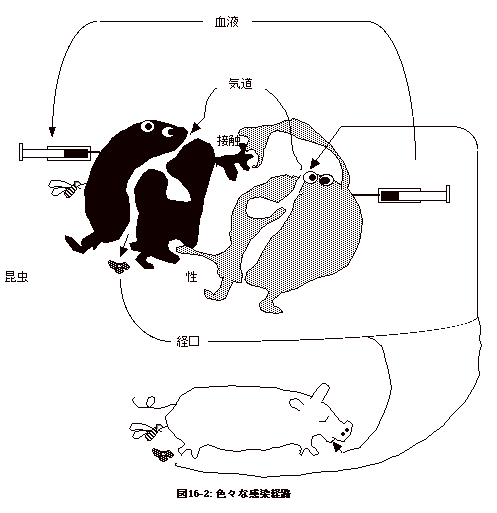
感染は病原体との出会いで始まる。感染を感染経路で分ける。即ち、
1.接触感染
2.気道感染
3.経口感染(水系感染、食物感染、食中毒)
4.昆虫媒介感染
5.性感染
6.血液感染
7.母子感染
性感染を起こす殆どの細菌やウイルスは血液感染や母子感染を起こす。胎児は胎盤を通じ母親から栄養の補給を受け、生殖器から血だらけで母親の体外に出てくる事を考えると、この事は容易に理解出来る。また、性行為で移る病原体は、密接な粘膜接触でないと人から人に移らないのであるから、体外では容易に活性を失う。逆に、皮膚の接触感染、気道感染、経口感染で伝播する病原体は体外で丈夫な菌である。また、気道感染をする菌やウイルスは空気中で感染性が失われない事から乾燥に耐える性質を持つ筈である。実験室でのバイオハザード対策で特に考慮を要するのはこの様な乾燥に強い病原体である。結核菌や天然痘ウイルスなどがこれに当たる。
病原体が人のみを宿主とするのか或いは他の動物も宿主とするのかは、その病原体の制圧を考える時に重要である。人にしか感染しない病原体はワクチン投与により撲滅可能である。天然痘は撲滅され、ポリオウイルスも米大陸から一掃された。
動物にも人にも感染する人畜共通伝染病のコントロールは、必ずしも容易ではない。欧州の狂犬病がその例である。現在、ワクシニアウイルスに狂犬病ウイルスの表面抗原を組み込んだ経口生ワクチンを散布する事で成果を挙げている。しかし、撲滅は難しい。
昆虫により媒介される病原体のコントロールは、その昆虫の駆除或は昆虫が吸血する動物の感染防御が可能なら或る程度成功する。日本脳炎はわが国で非常に数が少なくなった(それでも年間数人の死者が出る)。これは脳炎ウイルスを持つブタを都市部から隔離し且つワクチン接種をした為と考えられている。
マラリア原虫は蚊が媒介するが、コントロールは非常に難しい。開発途上国での治水事業は大きなプロジェクトであるが、水田や水路などは逆に蚊の温床を作る事にもなる。 |
|
 |
16−3:生体防御機構
動物は皮膚に覆われ容易に微生物が侵入出来ない。又、病原体が気道から肺に吸い込まれると、排気と同時に繊毛運動で外に追い出される。病原体が口から胃袋に入ると、強い酸性(pH
2-3)の胃液により酸性に弱い菌、例えばコレラ菌、は殺される。また、小腸では1日20リットルのものが通過し、菌を体外に押し流している。尿道に感染した菌はあたかも滝の中途にしがみついたカエルのようなものである。
鼻腔、口腔、或は大腸には常在菌が居る。4百から5百種(主なものだけで30−40種)も居るといわれる。外から入った菌はこれらの菌にとっては侵入者なので増えさせまいとする。実際、無菌マウスはサルモネラ菌に対して1万倍も感受性が高くなる。
16−4:抗原特異的免疫機構
免疫機構には、抗原に特異的な反応と非特異的なものがある。前者をadaptive
immunity、後者をnatural immunityとも云う。
ウイルスなどが感染すると、宿主の血液にはウイルスを不活性化するような物質、抗体が作られる。抗体を作るのはB細胞である。抗体は、ウイルスの中和や、細菌のopsonization(後述)をし、病原体をやっつける。これは、いわゆる液性免疫と云われるものである。
一方、ウイルスや細菌が感染し増殖する細胞は病原体の生産工場のようなものである。これを破壊するのが細胞傷害性T細胞(CTL)である。細胞性免疫とも云う。
以上の細胞の増殖をコントロールする中枢が、ヘルパーT細胞(Th)である。Th細胞が極端に少なくなったのがエイズ患者である。HIVはThに感染し破壊するので、免疫系統が完全に駄目になり、健常人が排除出来る菌でも重症の感染を起こす事になる。
抗原特異的な免疫は、B細胞、T細胞いづれについても、次の事が起きる。
1)遺伝的構成が同じである幹細胞の分化の過程で、抗原の認識に関わる遺伝子の再配列により、無限に近い異なった配列の抗原受容体遺伝子が出来る。つまり、世界に有り得る抗原の種類に対応するだけの異なった免疫細胞が出来る。任意の抗原と反応する免疫細胞は必ずその中にある。
2)抗原が生体に入ると、その抗原と反応する免疫細胞が刺激され、増殖し、抗原に対応する生体機構が増幅する。
即ち、免疫反応は、「抗原受容体遺伝子の再配列、並びに、細胞の増殖を介しての抗原に対応した抗原受容体遺伝子の増幅とその発現」とも云う事が出来る。
16-4-1:免疫系に於ける遺伝子の再配列
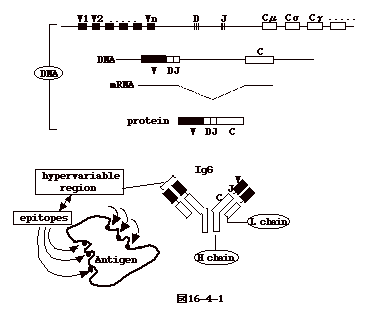
遺伝子の再配列は、次のように考えると良い。いま、抗体重鎖分子を考える。この分子は、可変部分(V領域:V,D,J
断片よりなる)、定常領域(C領域)の2つの部分から成る。V,D,J
断片およびC領域をコードする遺伝子は、染色体DNA上にお互い少しづつ離れて、この順序で並んでいる。D、Jのコピーは比較的少数であるが、Vは50-200位の多数の異なったコピーがある。B細胞の分化の過程で、V、D、Jそれぞれからどれか一つづつを選ぶ様に遺伝子の再配列が起こる。例えば、Vが200、D、Jが3とすれば、1800の組合せが可能である。同じV、D、Jのコピーを選んでも、組替えの時に連結部位変異が入るのでこの数は何桁も大きな数になり得る。C領域は抗体の性質、IgM、IgG、IgA、など(これをclassと云う)を決める領域である。細胞免疫に関わるTcR遺伝子の再配列についても、原理的には、ほぼこれと同じと考えればよい(図16-4-1)。 |
|
| 静止期のB細胞はIgM抗体分子を細胞表面に発現するが分泌はしない。活性化して初めてIgMを分泌する。これは、C領域下流に膜貫通領域をコードする断片をはさむ型で2つのポリA付加シグナルがあり、静止期では下流のシグナルを用いるためにmRNAに膜貫通領域をコードする部分が残るためである。活性化後は、上流側のpolyA付加シグナルを用いるためmRNAに膜貫通部位がなくなる。つまり、この場合には、転写後のスプライスによる制御がある事になる。 |
 |
16-4-2:液性免疫
抗体IgGは、B細胞が作る。重鎖(heavy chain)と軽鎖(light chain)からなる2量体が2つ付いた4量体である。各鎖は可変領域(variable
region)と定常領域(constant region)から成り、重鎖と軽鎖の可変領域が抗原結合領域を構成する(図16-4-1)。
一つのIgG分子を作る重鎖と軽鎖の可変領域の組み合わせの可能性は、それぞれの可変領域の数の積になる。このようにして得られる可変性をcombinatorial
diversityと云う。
感染初期には、B細胞はIgM抗体を生産するが、時間経過と共に同じ抗原特異性を持ったIgGを生産するようになる。従って特異的IgMの存在は感染が最近起こったものである事を示す。
IgMからIgGへの移行は定常領域DNAの再配列による。これをクラススイッチ(class
switch)と云う。IgMは5つのIgGが定常領域を内側にして環状にくっついたような構造をしている。IgGは血液中のウイルスを排除するのに大きな働きをしているが、この他の抗体クラスとして、アレルギー反応で大きな役割を果たすIgE、粘膜免疫に関与するIgAがある。
上に述べたように抗体のclass switchはDNAの再配列によるものである。その機構を理解するには、抗体をコードする遺伝子がどのように並んでいるか、もう一度確認する必要がある。要約すると、
V(D)J-Cμ-Cδ-Cγ3-Cγ1-Cγ2b-Cγ2a-Cε
となっている。V(D)Jが可変領域である。CμはIgM、CγはIgG、CεはIgEの定常領域である。始めはIgMが産生される。IgMは、上に示した再配列のない遺伝子から転写されたmRNAによりコードされる。しかし、IgGやIgEをコードするmRNAが転写されるには、V(D)JとCγやCεの間の配列は邪魔である。そこで、その配列をDNAの再配列により除かなければならない。これがクラススイッチである。
クラススイッチに於ける定常領域の選択にはヘルパーT細胞の出すサイトカインが関与している。T細胞がIL-4分泌すればIgMからIgG1叉はIgEへ、IFγであればIgMからIgG2aへ、TGFβ(transforming
growth factor-β)であればIgMからIgG2b叉はIgAなどである。どのようにしてサイトカインがDNAの組み換えを左右するのか不思議である。
B細胞が抗原刺激により増幅される場合、Thに依存する場合(後述)と依存しない場合がある。Th非依存性の場合はIgM産生に限られる。例としては、細菌の多糖体、例えば莢膜抗原など、に対する免疫反応がある。18ケ月以下の小児ではこの免疫系が発達していない。
H.influenzaeによる髄膜炎は生後3ヶ月から2年にほぼ限られる。それは、次のような理由による。この菌が髄膜炎を起こすには、菌が血流に入る必要があるが、血液中での菌の生残には莢膜が大きな役割を果たす。故に、髄膜炎からの防御には莢膜への抗体が必要である。処が、Th非依存性抗体反応の抗莢膜抗体は、2年以下では出来ないので、髄膜炎は2才以下に限られると云う訳である。この菌は肺炎も起こすが、この場合菌が血液に入る必要はないので、このような年齢分布を示す事はない。
以上の事から明らかなように、多糖体単独のワクチンは小児に抗体を誘導出来ず、役に立たない。多糖体をジフテリア毒素蛋白等に結合させ、2年以下の小児でも発達しているT細胞依存性抗体反応により抗体を作る工夫がなされている。
|
|
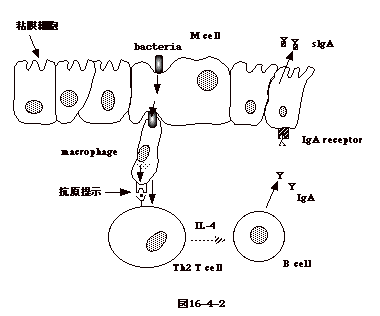 |
| IgA
は、粘膜から分泌され、腸管感染、気道感染、性行為感染、などを防ぐ。このような感染は血中の1gG抗体によっては有効に防御されない。チフス菌などが腸管細胞(マクロファージ系のM細胞)に感染し、粘膜下に到達すると、マクロファージに食われ消化される。粘膜下のマクロファージはそこでTh細胞に抗原を提示し、刺激されたTh細胞はチフス菌の抗原に対応する抗体を生産するB細胞を刺激する。B細胞はIgAを分泌する。分泌された
IgA は、腸管細胞の基底側にある IgA レセプターに結合する。IgA
は、IgA レセプターと結合した儘 vesicle
により細胞表面に運ばれる。ここで、IgA
レセプターの一部が切り離され、sIgA
として分泌される。この様な事から、腸管から感染する病原体に有効な免疫力を与えるには抗原を腸管から投与しなければならない。そこでジャガイモやバナナなど植物に抗原を発現させ、これを食べるワクチンとして利用することが考えられている(図16-4-2)。
16-4-3:免疫細胞間相互作用
これから、感染細胞を殺す細胞傷害性T細胞につき説明し、次に、免疫細胞系が細胞間相互作用により如何に機能的に統合されているか、について述べる事とする。免疫系の機能的な統合ではヘルパーT細胞が重要な役割を果たす。又、外から入ってきた病原体を認知し、免疫系に提示するのは、マクロファージなどの抗原提示細胞である。 |
|
| ヘルパーT細胞(Th)も細胞傷害性T細胞(CTL)も、抗体を作るB細胞同様、抗原特異性を持つ。しかし、抗原認識様式は全く異なる。 B細胞の表面に発現している抗体、或いは、B細胞から分泌された抗体は、蛋白分子としてその抗原を認識する。認識部位は抗原蛋白の一部(エピトープと云われる部位)である。しかし、Th、CTLいずれの
T 細胞も蛋白分子のままでは、抗原性を認識出来ない。
蛋白分子が数アミノ酸からなるペプチドに分解されて初めてT細胞に認識されるようになる。しかも、ペプチド単独では認識されない。必ず主要組織適合抗原
(MHC) にくっついた抗原断片でないと駄目である。即ち、MHC+抗原断片が、一体として認識される。その認識は抗原受容体(TcR)が行う。
それぞれの抗原に対応した抗体があるように、抗原断片に特異的な遺伝子配列を持つ
TcR がある。 |
 |
16-4-4:細胞傷害性T細胞
病原体の生産工場である感染細胞を除去する為の細胞性免疫は、細胞傷害性T細胞(CTL)が担う。
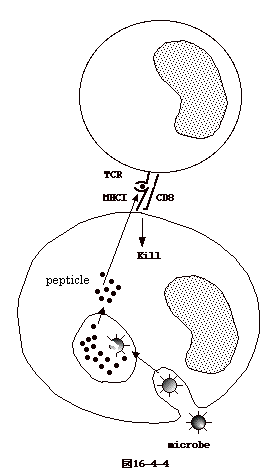
CTL は細胞表面マーカーとしてCD8を持ち、CD4は陰性である (CD4−CD8+)。CTL表面の
TcR は、総ての細胞が発現している細胞表面分子、class I MHC(MHCI)、により提示されたペプチドを認識する。同時に、CD8
分子は、親和性を持つ MHCI(註1) を認識する(図16-4-4)。この2重の認識により、ペプチド提示細胞を認識し、これを殺す。殺す機構として、Fas遺伝子産物、perforin、cytotoxin
が想定されている。
(註1)MHCIは同じ人でもで種々の型があり、あるMHCIではこのペプチド(抗原エピトープ)と云う様に認識に選択性がある。
ウイルスや細菌が細胞に感染すると、細胞はその構成蛋白を消化し数アミノ酸から成る抗原断片として
MHCI により細胞表面に提示する。従って、特異的 CTL
により殺される事になる。CTL が、class IIのような特定の細胞に発現される分子による提示抗原ではなく、全ての細胞に発現されているMHCIにより提示された抗原を認識する事は、生体防御にとって都合の良い事である。
ウイルス産生細胞がCTLにより殺されるのを免れるには、MHCIを発現しなければよい。アデノウイルスなどは感染細胞のMHCIの発現を抑えるような機能を備えている。
CTLに非常に似た機能を持つ細胞がありNatural Killer Cell(NK細胞)という。CTL
のようにあらかじめ活性化させる必要が無く直ちに標的細胞を殺す。NK
細胞の定義は上の様に機能的なものであるが、この様な細胞を欠損した個体があり、この様な人ではヘルペスウイルスや
リステリア菌Listeria monocytogenes 感染が非常に起こりやすくなる。
CTLやNK細胞の様な細胞により感染細胞が除去されなくても、ウイルスや細菌感染で細胞が素早く自殺するようなプログラムがあれば、生体防御機構として働く筈である。その様な機構としてアポトーシス(Apoptosis又はprogramed
cell death) が注目される。
そもそもは、線虫の発生の過程で、個体形成に邪魔になる細胞が、発生のプログラムに従って死んでいくことからこの現象は認識されるようになった。アポトーシスには、一連の遺伝子の発現が必要である。
植物には、ウイルス等に感染し細胞がすぐ死ぬ様な系統があり、ウイルス抵抗性の系統として知られてきた。又、感染細胞をすぐ殺してしまうウイルス株もあり、このような株は弱毒植物病原株として知られている。
病原体側からすれば、少なくとも自分の子孫を作る迄は、細胞の死を抑える機構が必要だと云う事になる。実際、ワクシニアウイルスには、宿主の細胞死を妨げる遺伝子を持っている事が分かった。
16-4-5:ヘルパーT細胞 (Th細胞)
ヘルパー T 細胞(Th 細胞)は、TcR 以外に表面マーカーとして
CD4 を持ち、CD8は陰性である(CD4+CD8−)。
マクロファージ、樹状細胞、B 細胞などの抗原提示細胞 (Antigen
Presenting Cell、APC)
は、抗原を取り込み、数アミノ酸からなるペプチドに消化する。これを、細胞はclass
II MHC(MHC II)と一緒に細胞表面に提示する。Th 細胞のTcR
は、この「MHC II+ペプチド」に結合するが、同時に、CD4 も MHC IIそのものに結合する。このようにして、Th
は APC
から特異的な抗原刺激を受け、増殖し活性化する。活性化した Th
はリンフォカインを分泌しマクロファージ、B細胞、CTL
を活性化させる。Thは、機能的に炎症に関わるTh1と抗体産生に関わるTh2とに分けられる(図16-4-5-1)。 |
|
16-4-5-1:Th1ヘルパーT細胞
Th1はマクロファージの活性化に関与する。マクロファージは、菌やウイルスを食べる機能を持つが、活性化されないと食べた菌やウイルスを壊す事が出来ない。マクロファージは菌やウイルスの蛋白をペプチドに消化し、出来たペプチドはマクロファージ表面にMHC
II+ペプチド抗原として提示される。
Th1細胞は、その表面のCD4とTcR分子により、抗原提示細胞の表面のMHCIIとペプチド抗原を認識し結合する。すると、Th
1は活性化されガンマ interferon(IFN-γ)を出す。IFN-γには細胞特異性はないが、
IFNーγを出すTh1細胞のそばにいる抗原提示したマクロファージが一番作用を受け、更に活性化し細胞内の病原体を殺せるようになる。又、活性化しTh1はIL2を分泌し、周囲のT細胞が増殖する事となる(図16-4-5-1)。
|
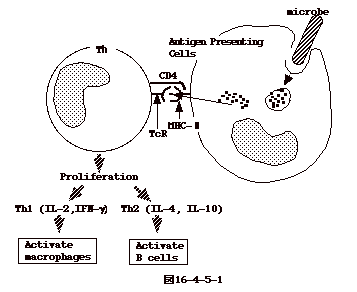 |
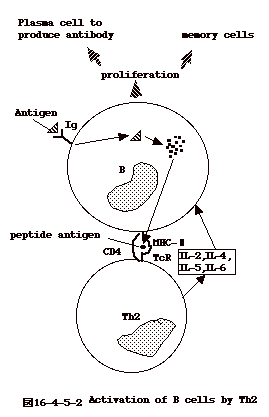
16−4−5−2:Th2ヘルパーT細胞
この細胞 は B 細胞の活性化に関わる。
B
細胞は表面に抗体分子を発現しているので、これに特異的な抗原が結合する。結合した抗原は細胞に取り込まれ、数アミノ酸に分解される。このようにして出来た数アミノ酸からなるペプチドはMHC
II と一緒にB細胞の表面に提示される。
このペプチドに特異的なTh2細胞は、表面の CD4 と TcRによりB細胞表面のMCHII+ペプチド
を認識し、結合する。結果、Th2細胞 は刺激され、IL-4、IL-5、IL-6
を分泌する。これらのサイトカインには抗原特異性はないが、そのTh2細胞を刺激した
B
細胞はすぐそばに居るので、これを増殖活性化させる事となる。この様にして、Th2は抗原特異的に
B 細胞を刺激増殖させる事となる(図16-4-5-2)。 |
|
 |
16-4-5-3:ヘルパーT細胞によるCTL活性化の特異性
ここで、CTL
の活性化に於いての抗原特異性はどうなっているのかもう一度考える。感染による炎症反応の結果、マクロファージなど
は、感染局所に集まり、病原体を消化しそのペプチドを提示する。この抗原提示マクロファージは
MHC IIもMHC I も発現しているので、一つのペプチドはMHC II
によっても MHC Iによっても提示され、前者は ヘルパーT細胞(Th)の
TcR で、後者は CTL の TcR により認識される。この場合、 Th と CTL
は同じマクロファージ とくっ付く状況になりえる。まずThが
抗原提示細胞により活性化され、IL-2
などのリンフォカインを分泌する。すると、同じペプチドを認識するCTLも同じ
マクロファージに付いているので、この CTL
を活性化する。すなわちThは、抗原特異的に CTL
を活性化する事となる。
16-4-5-4:Th1とTh2への分化を決めるもの
既に述べた様に、Th1は炎症反応を強く刺激し、Th2は抗体反応を刺激する。Th2
は IL-10 を分泌し Th1を抑制し、逆に Th1の分泌する IFN-γは Th2を抑制する、と云われている。すると、病態により、いずれかが過剰に優勢になると、宿主にとって、非常に不利になる事も有り得る訳である。エイズで
Th2 が優勢になるのが病状を悪化させる、つまり Th2が優勢になれば
Th1の方は劣勢になり細菌に対する防衛として重要なマクロファージの活性化が相対的に下がり、細菌感染などに弱くなる、と云われるのもこのような事を根拠にしている訳である。 |
|
| こうして見ると、Th1とTh2への分化の決まり方は生体防御の上で大変大切である。どのようにして決まっているのだろうか。樹状細胞(DC,
Dendritic
Cell)は幼若期には腸管粘膜のような抗原侵入部位に存在し抗原の捕捉を専門にしているが、成熟すると、末梢のリンパ組織に行き抗原捕捉能力を失い、代わりにT細胞を活性化する能力を持つようになる。成熟DCには、IL12を多量に分泌しTh1への分化を誘導する成熟DC(DC1と呼ぶ)と、Th2反応を誘導するリンパ球様のDC(DC2と呼ぶ)の2種類のDCのある事が分かった(図16-4-5-4)。 |
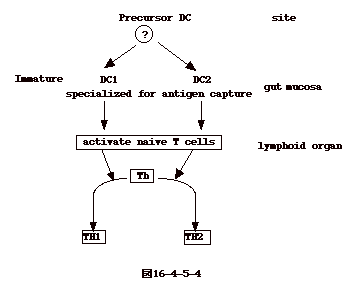 |
| 即ち、DCがTh1、Th2へのCD4T細胞分化を決めていると云う事になる。処で、サイトカインの内、IL12はTh1への分化を優位にさせ、IL4はTh2へのT細胞の分化を優位にさせる働きがあるが、意外な事にDC2はIL4を分泌していない。つまり、DC2によるTh2への分化はIL4非依存性である(M.C. Rissoan et al. Science, 283, 1183, '99)。以上のような事が正しいとすると、T細胞分化はDC細胞分化の問題に帰すると云うことになる。
16-4-5-5:免疫系組織間の細胞の動き
上のように樹状細胞がT細胞に抗原を提示し一連の免疫系の活性化が起こる訳である。しかし、樹状細胞は、生体の中を泳ぎ回りどうやってリンパ節のT細胞と出会えるのであろうか。それは、ケモカインがある細胞をある細胞に引き付ける役割を果たしている為ではないか、と考えられている。
この種のケモカインは分子量が小さく、細胞を引き寄せる力を持ち
(chemo-attractant)、強塩基性で、分子勾配を形成する例えば神経軸索の移動を道案内する蛋白(axon-guiding
protein)と似た性質を持っている。
上皮の樹状細胞であるLangerhans細胞は炎症局所から外へ出る前に、大量の炎症サイトカインを産生し、局所に更にLangerhans細胞を引き寄せ、炎症が続くようにする。炎症局所から出たLangerhans細胞は、リンパ節のT細胞領域で発現しているEpstein-Barr
virus-induced molecule 1 ligand chemokine及びリンパ節のhigh endothelial venulesで発現しているsecondary
lymphoid tissue chemokineに対する受容体CCR7の発現を高め、同時に、macrophage
inflammatory protein-1α、IL-8等、炎症組織で作られているサイトカイン受容体の発現を下げる。即ち、リンパ節のサイトカインへより良く反応するようになる。このようにしてリンパ節に入り分化したLangerhans細胞はT細胞領域で産生されているケモカインに引き寄せられ、T細胞に出会い、これに抗原を提示する。
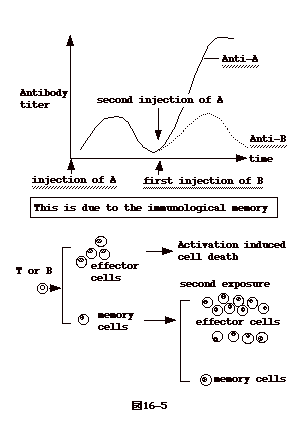
16−5:免疫の記憶
生体に抗原を投与した場合、初回よりも2度目の方が速やかに且つ高いレベルのしかも抗原に対しより強い親和性を持つ抗体を生産することが観察されている。これは、B
細胞には抗体を作る為の細胞(effector
細胞)の他に記憶する為の細胞(memory細胞)がある為と考えられている。
抗原刺激を受け活性したB
細胞は、胚中心を作って記憶細胞になるか、あるいは抗体生産細胞へ分化する。記憶細胞になる過程で抗体
V 領域遺伝子に高率に mutation が入り、抗原に高親和性を持つ Ig変異体が選ばれる。抗体生産細胞は、その後、activation
induced cell death(AICD)と云う機構で95%以上死滅する。記憶 B
細胞は、長い寿命を持っていて、次の抗体刺激が来ると直ちに抗体生産細胞に分化する。CD4+、或いは
CD8+T 細胞についても同様な memory機構があると考えられている(図16-5)。
16-5-1:ワクチン
上述のように、細胞性免疫、液性免疫、何れについても、免疫学的記憶と云う現象がある。一度、生体がある病原体に暴露されていれば、初回より遥かに短い時間で排除機構を発動させることが出来る。
病原性を欠いた変異微生物を先ず感染させ、免疫を誘導するのが生ワクチンである。殺した微生物を接種し免疫を誘導するのが不活化ワクチンである。ポリオ、麻疹、ムンプス(お多福風邪)、風疹、黄熱、などに対しては、生ワクチンが使用され、狂犬病、インフルエンザ、B型肝炎などには不活化ワクチンが使用されている。
安全性から見て、不活化ワクチンの問題は感染性ウイルスの残存であり、生ワクチンの問題は復帰変異により毒性が回復する事である。例えば、ポリオウイルスの場合、投与した人の中で増殖し次の人に感染した場合、人で増殖しやすい変異ウイルスが選択され、病気を起こす場合がある。 |
|
| 現在、生ワクチンを使用しポリオの根絶計画が進んでいるが、野生型ポリオが地球上から無くなったと判定された時、次にどのような手段を取ればよいか大きな問題になっている。上に述べた事から分かるように、ワクチン接種により、生ワクチン由来のポリオウイルスが野外にいる筈である。そのようなウイルスは、ワクチン接種により感染の拡がりが抑えられている。しかし、もしワクチン接種を止めてしまうと、感染サイクルを止めるものがないので、野性型ウイルスと似た病原性のある変異ウイルスが再び感染を始めるかもしれない。この様な状況に対して、不活化ワクチンを使用してはどうか、と云う提案がなされている。しかし、不活化ワクチンは麻痺病変の予防に対しては有効だが、腸管でのウイルス増殖は阻止しない。従って、その有効性については、疑問が出されている。 |
 |
| どうして、生ワクチンは腸管でのウイルス増殖を抑えるのに、不活化ワクチンが駄目かと云うと、生ワクチンは経口投与されウイルスが腸管で増殖し粘膜免疫を誘導するのに、不活化ワクチンは注射なので血液中のガンマグロブリン抗体を誘導するだけだからである。そこで上述のように、腸管感染をする病原体に対しては、遺伝子組み替えでウイルス抗原を発現する野菜を作り、食べて粘膜免疫が誘導される食べるワクチン(edible
vaccine)の開発がなされている。
16−6:抗原非特異免疫
先に述べた NK
細胞はこのカテゴリーに入り、ウイルス感染細胞の排除に貢献する。この他、幾つか重要な因子があるが、細菌感染に対しては、phagocyte(貧食細胞)と補体は特に重要である。
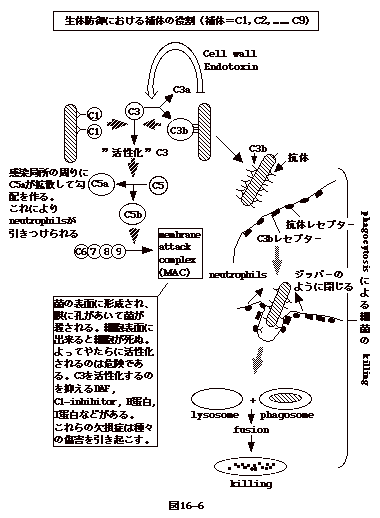
補体(complement)
補体は、C1 から C9
まである。補体が活性を持つには、一連の連鎖反応が必要である。連鎖反応の最初は
C3 の活性化で始まる。C3
を活性化するのは、細菌表面に付いた抗体に結合したC1、或いは、細菌表面に結合した
C3 が切れて出来るC3bである。活性化した C3 は C5 を C5aとC5b
に切断する。C5b は C6、C7、C8、C9 を細菌表面に集合させ MAC(membrane
attack complex)をつくる。MAC は細胞膜に穴をあけ、菌を殺す(図16-6)。
|
|
貪食細胞(phagocytosis)
菌体表面に C3b
が結合するが、貧食機能を持つ好中球の表面には C3b
レセプターがあり、これを介しあたかもジッパーを閉じるかのように菌は細胞に取り込まれ
phagosome に入る。
同様な事が、抗体が菌体についた場合にも起こる。貧食機能を持つ好中球表面には抗体レセプター(Fc
receptor)がある。抗原認識するFab部分で菌体に付くとFc部分が菌から外側へ突き出た格好になる(opsonization)。これが細胞のFcレセプターと結合するので、やはりジッパーを閉じる機構で細胞に取り込まれる
事となる。phagosomeは lysosome と融合し、lysosome の中のlysozyme、elastase、protease
等で消化されたり、myeloperoxidaseにより
酸素依存性に殺される。病原性結核菌やサルモネラ菌は、phagosome
と lysosome との融合を抑える因子を出し、細胞内で増え続ける。
C5 切断産物の片割れである C5a
は感染局所の周りに拡散し、好中球を引き寄せる(図16-6)。
貪食細胞がこのような機能を発揮するにはIL-1やNTF-αによる活性化が必要である。つまり、細菌等が感染するとこれらのサイトカインが誘導されなければならない。次第にこの機構が明らかになりつつある。即ち、Toll-like
receptorの発見である。
Tollはショウジョウバエの発生において背腹のパタン(dorsoventral
patterning)を決める遺伝子として発見された。処が、ハエが生育を遂げてからのこの遺伝子の機能を調べてみると、つまり成虫になってからこの遺伝子発現を止めてやると、カビに感染し皆死んでしまった。これは、抗カビペプチドdrosomycin産生が誘導されない為であった。
一方、C3H/HeJマウスはグラム陰性菌の外膜にあるLPSに反応しない事が分かっていたが、その原因遺伝子がショウジョウバエのToll遺伝子と高いホモロジーを持つことが分かった。LPS刺激はマウスでIL-1やTNFを活性化し感染防御に関わっているので、ハエでもマウスでもTollに似た遺伝子が感染防御に関わっていることになる。Tollとホモロジーを持つ遺伝子がその後沢山とれて、Toll-like
receptor、TLR、と呼ばれる。TRLには特異性があり、例えば、C3H/HeJで変異していたのはTLR4でLPSに特異性があり、TLR2とTLR6は細菌のペプチドグリカンを認識し、TLR5は鞭毛を、TLR9は細菌のDNAを認識する。IL-1やTNFの活性化はNFκBの活性化を介した転写誘導による |
|
 |
インターフェロン
インターフェロン(IFN)にはα、β、γがあるが、いづれにも抗ウイルス作用がある。IFNγ
は既に述べたように T 細胞が生産する。
INFα、IFNβ はウイルス感染細胞(B細胞、線維芽細胞、マクロファージ、上皮細胞など)が生産するが、2重鎖
RNA が強い誘導活性を持っている。作用機構は翻訳停止並びに mRNA
をこわすことによるとされている。C 型肝炎ウイルス感染の30ー50%に有効である。 |
|
|
|
|