��U�́@��`�q�Ƃ��̔���
|
|
|
|
| �����������Ă����ׂ̑S�Ă̏���DNA
�ɂ���BDNA �� RNA�ɓǂݎ���A�`���ɖ|���B�����ɁA���̐����������c��ׂɂͤDNA
�͐��m�ɕ�������q���ɓ`�����Ȃ���Ȃ�Ȃ��BDNA
�͈�`�q�����ƕ����̗��ʂ���l���Ȃ���Ȃ�Ȃ��B�����ł́A�O�҂������B �@�ۂ�RNA
�����A�`�������̊T�v���������B�����זE�i�^�j�זE�j�Ɗ�{�I�ɈႤ�_������B
�ۂɂ͊j���Ȃ��B�����זE�ɂ͊j������B�j�͊j���ōזE���ƕ������Ă���B�����ۂł͊j��������DNA�]�ʎY�����b�Z���W���[RNA(mRNA)
�̊j�זE���ڍs�̉ߒ��������B
���ׁ̈A�ۂł� DNA�����ARNA�ւ̓]�ʁARNA
����`���ւ̖|�����ɋN����i�}6�j�B
�@DNA����������ȋۂł͕����P���E���h�I���Ȃ����Ɏ���DNA�������n�܂�B���̂悤�ȏ�Ԃł́ADNA�����J�n�_�iorigin�j�ɋ߂���`�q�̓R�s�[�������Ȃ�B���̗l�Ȏ��f���āA���{�\�[��RNA��`���̂悤�ɑ��B�̗ǂ��ۂő�ʂ̔�����v��������`�q��DNA�����J�n�_�ɋ߂����ʂɂ���B
�����זE�ł́A�j���œ]�ʂ��ꂽ RNA�́A���ς��čזE���֑��肾�����B�j����
RNA��DNA�z������̂܂ܔ��f���Ă��邪�A�זE���ɏo��RNA��5'�[�� cap�\��������3'�[�Ƀ|���`�z������B�����̈�`�q��intron�������A�זE���ɗA�����ꂽRNA�͂���������Ă���isplicing�j�B�זE���ɗA������`�������̒��^�ƂȂ镔����
exon �Ɖ]���B
��ʓI�ɉ]���ē����זE�� mRNA��monocistronic�ł��邪�A�ۂ�mRNA��
polycistronic�ł���B�����A�����זE�� mRNA�͖|��J�n�_����Ȃ̂ŁA�P�̒`�������R�[�h�o���Ȃ��B
�@�ۍזE�ł́AmRNA�͕����̖|��J�n�_�������A�����̒`�����R�[�h����B���̕����̒`���́A�@�\�I�ɓ����ɔ�������鎖���K�v�Ȃ��̂ł���B�Ⴆ���N�g�[�X�̍זE�ւ̎�荞�݂ƕ������s���y�f�Q�͂P��mRNA����|���B�]�ʒ��߂ɂ��A�K�v�Ȉ�`�q�Q�̔�������x�ɒ��ߏo�����ł���B
�@���̂悤�ȓ]�ʒP�ʂ��I�y�����ioperon�j�Ɖ]���B
�����זE�Ɋ�������E�C���X�ŁA�P�{��mRNA�����o���Ȃ��E�C���X�A�Ⴆ�|���I�E�C���X�́A�P��ނ̒`���������Ȃ��B�������A�E�C���X�́A�E�C���X���q�`���ARNA�����y�f�ȂǕ����̒`����K�v�Ƃ���B���̏ꍇ�A����Ȓ`�����܂��o���āA���ꂪ�K�v�Ȓ`���ɐ��Ă����ipost-translation
cleavage�j�B
�咰�ۂł� DNA �ˑ� RNA
�|�������[�[�͂P��ނł���B�^�j�זE�ł�DNA �ˑ� RNA
�|�������[�[�͂R��ނ���B
�@PolI ��rRNA�i18S,5.8S,28S�j���APolII �� mRNA���APolIII ��5SRNA��tRNA
��]�ʂ���B
|
|
 |
�@
6�|1�F��`�q�����̒���
�@�ۂ͊��ɉ����A�Q���邩�A�剃��A�̐����𑗂��Ă���B�G�T������Β����Ɏ�荞��ŗ��p���A�����Ȃ�Α��₩�Ɉ�ؖ��ʂȃG�l���M�[�����Ղ��Ȃ����R�����ɓ���Ȃ���Ȃ�Ȃ��B
�@���̑�Ӓ��߂͑�ό����悭���f�������ł���B��̂ǂ�����Ă���̂��낤���H
�@��ӂ͍y�f�ɂ���Đi�s�������A��ӂ̒��߂͌����ւ���ƁA�y�f�̍������邢�͊����̒��߂ł���B�܂��A���ɑ��₩�ɑΉ�����Ɖ]�����Ƃ́A�����̎�荞�݂ƃJ�b�v���������ۂł��锤�ł���B
�@���߂ɂ͎�X�̋@�\���m���Ă���B�܂Ƃ߂�Ǝ��̗l�ɂȂ�B
�@1�DStringent control
�@2�DGenetic constitution
�@3�DControl of operon expression
�@4�DRegulation of enzyme activity
6�|2�FStringent Control
�@�ۂ�V�����|�n�ɐA����ƁA���̎��Ԃ�u���đΐ����B���ɓ���B�h�{��_�f������s�����ƁA���B���~�܂�A�Î~���ƂȂ�B�h�{��������A�����ɑ��B����������B
�@���̎��A�זE��RNA�ʂׂ�ƁA�זE���B��RNA�ʂ͕��s���ē����Ă��鎖��������B�Î~���̔|�{�ɉh�{��������ƁA�܂��ARNA���������A����DNA�������n�܂�B����RNA�̑啔���̓��{�]�[��RNA�ł���i�}6-2�j�B
�@DNA�����ARNA�����A�`�������ɂ�����k�N���I�`�h���̓A�~�m�_���d�����鑬�x�́A�זE���B�̑��x�ɍS�炸���ł���A�]���đ������ʂ͍����J�n�̕p�x�Ō��܂�B
�@ |
|
�@���B�̑����זE�͂��ꂾ����R�̒`�������Ȃ���Ȃ�Ȃ��B���ׂ̈ɂ́A��R�̃��{�]�[��RNA�irRNA�j
���o���A���ꂪ�Ђ��[����mRNA
�ɏ������A�Ђ��[����`���������N����悢�B�i������RNA�������Ђ��[����N����X�ɒ`������������ɂȂ�B�j�G�T���Ȃ��Ȃ�����`�������Ȃǂ����A�����Ǝ��̃G�T�����閘�҂��Ȃ���Ȃ�Ȃ��B���ׂ̈ɂ͒�����rRNA�������~�߂�K�v������B����rRNA�����̒��߂�
stringent control �ł���B
�@����̋ۂɁA���̗l�Ȓ��߂��i���`�q�����鎖�́A���̒��߂������ψً�(RelA-�j�������鎖�ŕ�����i�}6-2�j�B |
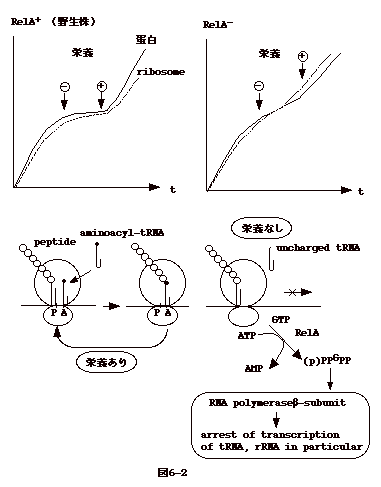 |
| �@stringent control ���s����`�q�� Rel A
�ƌĂ��B�G�T�������Ȃ�ƒ`�������ɕK�v�ȃA�~�m�_�����R����B��������ƁA�A�~�m�_�ƌ������Ȃ�
tRNA ���������A�`���������� ribosome �̃A�~�m�_����� A site
�ɃA�~�m�_�̕t���Ă��Ȃ� tRNA
������ė���B���ꂪ�������ƂȂ��āA(p)ppGpp ���������� RNA
�|�������[�[�� ��-subunit�ɔ��������̊�������������B���̌��ʁA�܂�tRNA,
rRNA �̓]�ʂ��~�܂�BRelA�|
�ψي��ł́A�G�T�������Ȃ��Ă� (p)ppGpp ���o����rRNA
�������~�܂�Ȃ��i�}6-2�j�B
6�|3�F�]�ʂ�DNA�����̑��x
�@�זE���B���x��]�ʎY���̗ʂɊւ�炸�A���̒l�́A37�x�ň��ł���B
�@DNA�F 800 nucleotides / sec
�@RNA�F 80 nucleotides / sec
�@protein�F 16 amino acids / ribosome / sec.
�@DNA�����̎��A��d��DNA��supercoil�������Ȃ��瓮��gyrase �̑��x��100
supercoils�^min�ł���B�����g�����̍ہARuvB���֗^����branch migration(��q)��10�`20nucleotides�^sec�ł���B
�@RNA�����̕���DNA�������̂낢�B���������DNA��������_(replication
fork)��RNA polimerase�ɒǂ�������B���ADNA����������RNA�����������t�����łԂ��鎖�����邾�낤�B���̗l�Ȏ��A�ǂ�Ȏ����N����̂��낤���B
6�|4�FmRNA�֖|��Y�����������鎖�ɂ��|��
�@ribosome ��rRNA �ƃ��{�]�[���`�� (r-protein)
���琬��B�����ꂪ��R�o���߂��Ă������������B |
|
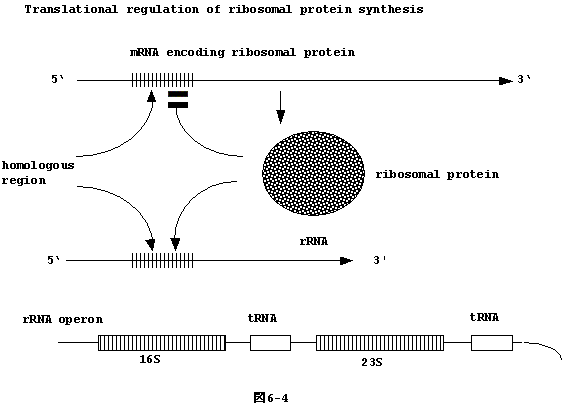 |
| �@rRNA�̈ꕔ�̉���z��� r-protein
���R�[�h���Ă��� mRNA �̈ꕔ����z��Ǝ��Ă��� (homologous)�Ar-protein
�� rRNA, mRNA ������Ƃ������o����B�]���āA���� r-protein
���o���߂��ArRNA�ƌ����o���Ȃ��Ȃ��mRNA�ƌ�����r-protein�̖|���}����B����́A�|��
(translational regulation)�̗ǂ���ł���i�}6-4�j�B
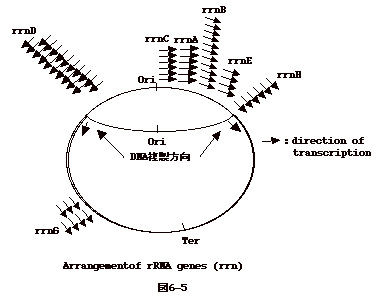
6�|5�F��`�q�\���iGenetic Constitution�j�ɂ�����
�@�ۂł́ADNA�����ARNA�]�ʁA�`���ւ̖|�����ɋN����B�]���āADNA
������ɂ���Ă���ۂł́ADNA �����J�n�_(Ori)
�̂��������̈�`�q�͗y��DNA �����I�~�_(Ter)
�߂��̈�`�q���R�s�[���������Ȃ�B
�@�咰�ۂ̈�`�q�n�}������ƁA��x�ɑ�ʂɍ��������K�v�̂���
rRNA, r-protein �̈�`�q�́AOri
�߂��ɏW�܂��Ă���A���A���̓]�ʕ�����DNA
���������������Ă���B�܂�A�����_�̐i�s�Ɠ]�ʂ��Փ˂��Ȃ��悤�ɂȂ��Ă���i�}6-5�j�B |
|
 |
�@
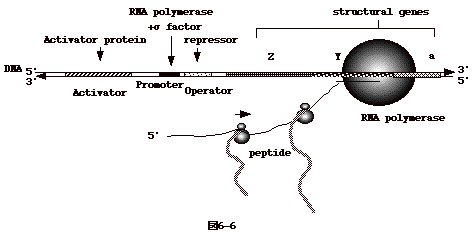
6�|6�FControl of Operon Expression(�I�y������������)
�@���̒��ɂ́A���̂��̂��܂܂��B
�@�@�P�DCatabolite repression
�@�@�Q�DRegulation by repressor or by inducer
�@�@�R�DTranscription regulation coupled with translation
�@�@�S�DAnti-termination
�@�@�T�DChoice of transcription initiation site �� factor
�@�@�U�DRNA stability
�@��������A�`�����R�[�h����mRNA
�̔����ʂ߂���@�\�ł���BmRNA �̓]�ʂ͈ȉ��i�}6-6�j�̂悤�ɐi�s����B |
|
 |
�@
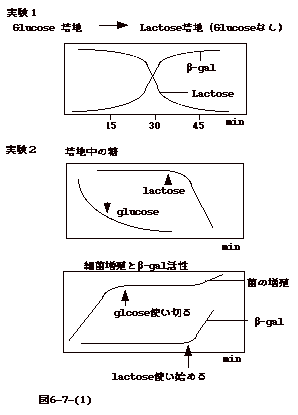
6�|7�FLactose Operon
�@���N�g�[�X�I�y����(lactose operon)���ɂ���catabolite repression��repressor����inducer�ɂ�钲�߂��������i�}6-7-(1)�j�B
�@�����P�D�O���R�[�X�|�n�Ŏ����Ă����咰�ۂ����N�g�[�X���܂ޔ|�n�ɓ����B���Ԃ�ǂ��A���N�g�[�X�ʂ�
��-galactosidase ( lactose��glucose��galactose
�ɉ�����������y�f�j��ʂ�Ǝ����P�̂悤�ɂȂ�B
�@�����Q�D��̎����ŋۂ�A�����ޔ|�n��glucose��lactose
�������܂ނ��̂ɕς���B���l�ɓ��ƃ�-galactosidase (��-gal )�̗ʂ�ʂ�B�����Q�̗l�Ȍ��ʂɂȂ�B
�@�����P�ł́A15���� lag �̌��-gal ���������n��60���őS�ے`����3�����߂�ɂ�����i����́A1,000�{�̑����ł���j�B��-gal�ɂ��Alactose
��glucose �� galactose �ɕ�������A�ʂ������čs���B�܂�Alactose
���|�n�ɉ����炦�����Ń�-gal ���U�� (induce)
�����B�]���Ĥ����܂ł́A��-gal�̔������}�����Ă����A�ƍl������B�����Q�ł́Aglucose������Ԃ�
lactose �̗��p���}�����Aglucose �������Ȃ��ď��߂� lactose�������n�߂�B�܂�A
glucose ������ƁAlactose�������Ă���-gal �� induce ����Ȃ��B�܂�
glucose �̓�-gal �̔�����}����Bglucose �� lactose �̑�ӎY��(catabolite)
�Ȃ̂Ťglucose���݉��Ń�-gal�̔������}�����Ă��邱�Ƃ�catabolite
repression �Ɖ]���B
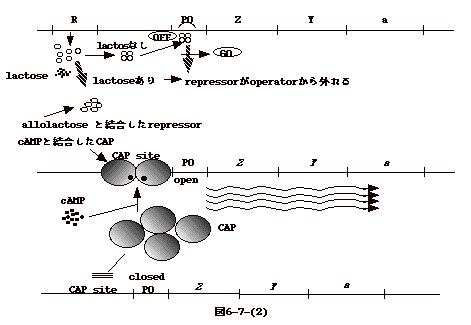
�@���q�@�\�͈ȉ��̒ʂ�ł���i�}6-7-(2)�j�B
- lactose ��������Ԃł� repressor �͂S�ʑ̂ƂȂ� operator �Ɍ����� RNA
polymerase ��promoter �ւ̐ڋ߂�W����B���ʁA�]�ʂ���������B
- lactose ��|�n�ɓ����ƁAlactose ��isomer �ł���allolactose��repressor
���������repressor��operator�Ɍ����o���Ȃ��Ȃ�B���̌��ʁARNA
polymerase��promoter �Ɍ������]�ʂ��\�ƂȂ�B�������ARNA polymerase���]�ʂ��n�߂�ɂ͏㗬��CAP
site��CAP�Ƃ����`�����t���K�v������B���ꂪ�����Q�ɊW����B
�����A
- glucose �����݂���ƁAglucose
�̎�荞�݂ɃJ�b�v�����āA�����_�����ꂽIIIg/c
���E�����_����i�}4-(6)�Q�Ɓj�B
- ATP ���� cAMP �����adenylate cyclase �̓����_�����ꂽ IIIglc
��K�v�Ƃ���Bglucose ����荞�܂��ƁAIIIglc�͒E�����_������cAMP
����������Ȃ��i�}4-(7)�Q�Ɓj�B
- lactose operon �� promoter �� RNA polymerase�����ɂ́ACAP (catabolite
activator protein ) ��cAMP��������dimer �ɂȂ�Apromoter �㗬�� CAP site
�Ɍ�������K�v������B
�@ |
|
| �@�]���āAglucose �̖����ꍇ�̂� cAMP
�Z�x���オ��ACAP�́@cAMP �ƌ�������B���̌��� cAMP�ƌ�������CAP��dimer�����A���ꂪ
CAP site �ɕt���B�t��glucose�������cAMP�������Ȃ�ACAP��CAP site�ɕt�����Alactose
operon��OFF �ɂȂ�B �@���̌n�́A�����̎�荞�݂ƁA���̕����̑�ӂɊW�����`�q�������J�b�v�����Ē��߂���Ă���ǂ���ł���BCatabolite
activator protein ������]�ʒ��߂� catabolite repression�Ɖ]���B |
 |
 |
�@
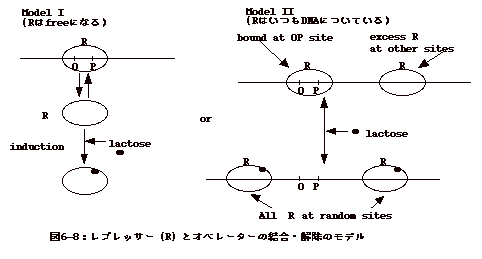
6�|8�F���v���b�T�[�ƃI�y���[�^�[�̌����E��
|
| �@���N�g�[�X�I�y�����̏ꍇ�Alactose����������Ƃ��ꂪ���v���b�T�[(R)�Ɍ������Alactose�̕t�������v���b�T�[�̓I�y���[�^�[(OP)�Ɍ������Ȃ��Ȃ�Blactose�̋����������Ȃ��lactose�̓��v���b�T�[����O��A���v���b�T�[�̓I�y���[�^�[�Ɍ�������B���̋@�\�ɂ��lactose�����݂��鎞�������N�g�[�X�I�y������ON�ɂȂ�B����́A���Ɍ����̂悢����n�ł���B �@�I�y���[�^�[�ɕt���Ă��Ȃ������v���b�T�[�͂ǂ��ɂ���̂��낤���B�����A���ꂪ�זE���̒������R�ɂӂ���Ă���Ƃ���ƁAlactose�̋����������Ȃ�Alactose�����v���b�T�[����O��Ă��A�����I�y���[�^�[�ɂ����t
���A�I�y�������I�t�ɂ����ɂ͍s���Ȃ��̂ł͂Ȃ����A�Ɖ]���^�₪�N����B�����ŁAlactose�̌����������v���b�T�[�͍זE���Ƀt���[�ɕY���Ă���̂ł͂Ȃ��ADNA����Ƀ����_���ɂ����t���Ă���̂ł͂Ȃ����A�Ɖ]�����������܂ꂽ�B
�@�����ŁA�I�y���[�^�[���ʂƂ���Ɠ����T�C�Y�̂���ȊO�̕��ʂւ̃��v���b�T�[�̌����ׂ��B���v���b�T�[�P�Ƃ̏ꍇ�A�I�y���[�^�[�ւ̌�����2x1013�i���ΒP�ʂŁA�傫���l�̕��������������j�ł���̂ɑ��Alactose���t���Ƃ��̒l��2x1010�ƂȂ�B����A����DNA�����ւ̌����́A�����2x106�ł������B�]���āA�@�@���v���b�T�[�P�Ƃ̎��̃I�y���[�^�[�ւ̌������ِ���
�@�@�@�@�@�@�@�@2x1013/2x106=107�@
�@�ł���̂ɑ��Alactose���t����
�@�@�@�@�@�@�@�@2x1010/2x106 =104
�@�ƂȂ�B
�@lactose���t���Ă��Ă��A���v���b�T�[�̓I�y���[�^�[�ɂ���ȊO�̕������104�{�������₷����ł���B�����A����DNA�����ɕt���m���́A�Y��������DNA�̒����ƌ����̂��Ղ��̐ςɔ�Ⴗ��B�]���āA�I�y���[�^�[�ȊO��DNA�����̓I�y���[�^�[���ʂ���104�{�ȏ�̃T�C�Y������̂ŁAlactose���t���Ă��Ă����v���b�T�[���A�I�y���[�^�[�ȊO�̕�����荂���m���Ō������邱�Ƃ͂Ȃ��B�����Alactose���t���ƃ��v���b�T�[��
�I�y���[�^�[�ւ̌������ِ��͏�������B
�@���̂悤�Ȏ�������lactose�̕t�������v���b�T�[�͏��DNA����ӂ���Ă��邪�Alactose���O���ƃI�y���[�^�[�Ƃ̌��������܂�A���ʂƂ��ē��ٓI�ɃI�y���[�^�[�Ɍ������鎖�����������Ɏ������iB.
Levine, Genes IV354�357��)�i�}6-8�j�B |
|
 |
�@
6�|9�F�A���r�m�[�X�I�y����
�@�A���r�m�[�X�I�y�����́ACAP�`���ɂ��Catabolite repression���A���A�A���r�m�[�X���݉���ON�ɂȂ�A�Ɖ]���_�Ń��N�g�[�X�I�y�����Ɨǂ����Ă���B
�@�������A���̂悤�ȓ_�Ŋ�{�I�ɈقȂ鐫���̂��鎖�����������B
�@(1)araC��`�q�̓A���r�m�[�X�I�y����(AraABD)�����ɕK�{�ł���A���̒���(inducer)������ƍl����ꂽ�B����
�@(2)�A���r�m�[�X�̑��݂Ɉˑ������A���r�m�[�X�I�y������ON�ɂ���悤��AraC�ψي�����AraC�̕���diploid�����A�A���r�m�[�X�ɂ��I�y�����U���ׂ��
�쐶�^�̕\���^���������B����AraC��inducer�ł���Ώ�ɃI�y������ON�ƂȂ�ψ�AraC�̕\���^���������ł���B
�@���̗l�ȁA�u�����ɍ���Ȃ��v�_���𖾂��悤�Ƃ��Č������Ȃ��ꂽ�B�Q�l���Ƃ��ď��߂ɏЉ���{�̒��ҁASchleif�͈ȉ��ɏq�ׂ錻�ۂ̉𖾂ɑ傫�ȍv���������l�ŁA���̌����̋ؓ����Љ���{�ɋ����[���q�ׂ��Ă���B
�@�A���r�m�[�X�I�y�����̍\����}6-9�̈�ԏ�Ɏ����Ă���B�E�ɓ]�ʂ����mRNA���烉�r�m�[�X�����Ɋւ��y�f�`��araB�AA�AD���|���B���߂Ɋւ��araC�͍����ɓ]�ʂ����B
�@�A���r�m�[�X�����݂��Ȃ����ɂ͐^�Ɏ����悤�ȁADNA���܂�Ȃ������\�����Ƃ�AaraC�`�����Q�ʑ̂ƂȂ��āAaraO2��I1�Ɍ�������B�E���ւ̓]�ʂ͋N����Ȃ��B |
|
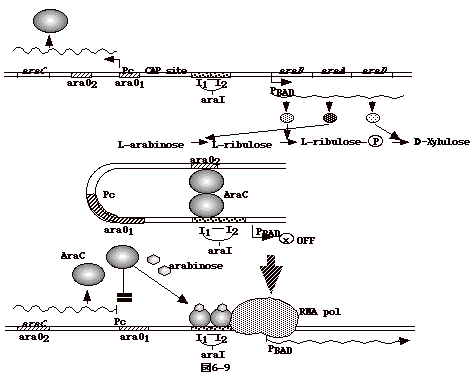 |
�@�A���r�m�[�X��|�{�t�ɓ���Ă��ƁAaraC�ƃA���r�m�[�X���������AaraC�̍\�����ς��AI1��I2(araI)�ɐ}�̂悤�Ɍ�������B����ƁARNA�|�������[�[���ׂ̃v�����[�^�[�̈�ɂ��₷���Ȃ�AaraBA�cmRNA���]�ʂ����B
�@araC�͍����ʂ������Ȃ�ƁA�������g�̃I�y���[�^�[�Ɍ������A�������g�̓]�ʂ�OFF�ɂ���B�A���r�m�[�X�����݂��Ȃ���Ԃł́AaraC�̃v�����[�^�[�����iPc�j��DNA�̐܂�Ȃ���̒��ɂ���A���炭���ׁ̈A�]�ʂ�OFF�ɂȂ��Ă���B
�@CAP�`�����������镔����araO1��araI�̊Ԃɂ���A�O���R�[�X�̎�荞�݂ɘA�������A�f�j���[�g�V�N���[�[�iadenylate
cyclase�j�̊����ɂ�鐧�����B�i�O���R�[�X�������cAMP���Ȃ��̂�CAP�����������A���r�m�[�X�I�y������OFF�̂܂܂ł���B�j�@�A���r�m�[�X�I�y�����œ����I�Ȃ̂́ADNA�̐܂�Ȃ���ł���B�܂�Ȃ���̑��݂�������������I�؋��Ƃ��āAI1��araO2�Ԃɉ����}����������������B
�@DNA�̂P�点���]���ihelical turn�j��10����̑}���ł͂Ȃ��e�����Ȃ��̂ɁA���点���]���ɓ�����T�A�����́A15�̉���������araC�ɂ��repression���ʂ������Ȃ鎖���ώ@����Ă���i+5�̖@���Ɖ��ɌĂԁj�B����]����ƁA�܂�Ȃ��������A���݂��Ɍ��������̈�̈�����O���������Ă��܂��̂�repression�̌��ۂ������Ȃ�Ɖ��߂����B
�@�^�j�זE�œ]�ʌ������グ��G���n���T�[�`�����v�����[�^�[����y�����ꂽ�G���n���T�[���ʂɕt���ADNA�̐܂�Ȃ���ɂ���ăG���n���T�[�`����RNA�����Ɋւ��`�������N���[�g����ꍇ�ɂ�+5�̖@�������݂���P�[�X������B
�@araC�ɃA���r�m�[�X����������ƁAaraC�̍\���ω����N����A����ɂ��DNA�ւ̌����l�����ς��_�͌��ʂ��t�Ȃ����Ń��N�g�[�X�I�y�����̃��v���b�T�[�̏ꍇ�ƑS�������ł���B
�@���A�A���r�m�[�X����araC��ʑ̂��v�����[�^�[�㗬��araI�ɕt��RNA�|�������[�[���v�����[�^�[���ʂɃ��N���[�g����_�́A��q�́A�����_�t�@�[�W�ɂ����郌�v���b�T�[cI���������g�̃I�y���[�^�[�^�v�����[�^�[�̈�OR1�AOR2�ɕt��RNA�|�������[�[��t���₷������̂Ɨǂ����Ă���i�}13-2-5�Q�Ɓj�B
�@ |
|
6�|10�FRegulation coupled with translation�i�|��A���]�ʒ��߁j
|
| �@����́A�ۓ��L�̌��ۂƉ]���Ă悢�B�ۂł�
mRNA �ւ̓]�ʂƂ��ꂩ��̖|��͓�����œ����i�s����B �@�����זE�ł́A�j��
mRNA
���o���A���ꂪ�זE���ɗA������Ė|�N����B�܂�A�]�ʂƖ|��̏ꂪ�قȂ�B�]���āA�|�]�ʂɉe����^����@��͖����B
�@�ۂ̃A�~�m�_�����Ɋւ�� operon�ł���trp�A phe�A his�A thr�Aleu
���ł́A���i�K�̒��߂Ƃ���, lactose operon�Ɠ��l repressor
�ɂ�钲�߂�����B���̏ꍇ�́A���ꂼ�ꍇ�������A�~�m�_��
repressor�ƌ������邱�Ƃɂ��repressor��operator
�Ɍ����ł���悤�ɂȂ�A�]�ʂ��}������B
�@�������A������ operon�ɂ͑��i�K�̒��߂�����B���ꂪ�|��ɘA�������]�ʒ��߂ł���B
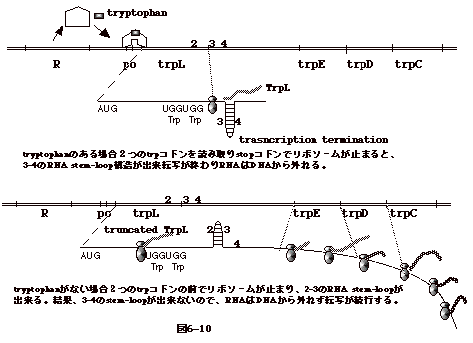
�@�g���v�g�t�@�� (trp) operon �@���ɂƂ�B
�@promotor-operator �Ɉ��������A�g���v�g�t�@�����R�[�h����triplet
(UGG)�������z����������Z���ǂݎ��g open reading frame (ORF)
������AUGA ��stop codon�ŏI��B����ORF��trpL�ƌĂԁB
�@�g���v�g�t�@�������Ɋ֗^����y�f���R�[�h�����`�qtrpE,trpD,
trpC, trpB, trpA �� trpL �̉����ɂ���B�����AtrpL
�̂��������œ]�ʂ��~�܂�ƁA�g���v�g�t�@�������y�f�̃R�[�h�̈�͓]�ʂ���Ȃ��܂܂ɂȂ�AtrpL
�݂̂��R�[�h����Z��mRNA �������o���邱�ƂɂȂ�B
�@tryptophan �̑��݉��ł́A�Q�� trp �R�h����ǂݎ�� stop
�R�h���Ń��{�]�[�����~�܂�B����ƁA�R�|�S�� RNA stem-loop
�\�����o���A�]�ʂ��I��� RNA �� DNA ����O��A���ʁAtrpL
�݂̂��R�[�h���� mRNA ���o����i�}6-10��j�B
�@tryptophan ���Ȃ��ꍇ�A�Q�� trp
�R�h���̑O�Ń��{�]�[�����~�܂�A�Q�|�R��RNA stem-loop ���o����B
���ʁA�R�|�S�� stem-loop ���o���Ȃ��̂ŁA RNA �� DNA
����O�ꂸ�]�ʂ����s����B
�@���̎��A trpL �̖|��� trp
�R�h���̏��Ŏ~�܂邪�A���j�זE�ł͂��ꂼ��̈�`�q(cistron)��Ɨ��ɖ|������|��J�n�_(internal
ribosomal�@entry site)������̂ŁA������ trpE , trpD
�Ȃǂ͖|��邱�ƂɂȂ�i�}6-10���j�B
�@�g���v�g�t�@�������y�f���R�[�h�����`�q trpE�AtrpD�AtrpC
�ɂ̓g���v�g�t�@�� codon
�͑��݂��Ȃ��B�]���āA�g���v�g�t�@�����|�n���ɖ����Ă��A�g���v�g�t�@�������y�f�͏o����d�g�݂ɂȂ��Ă���B����́A�]�ʂ�
anti-termination �̈��ł���B�ȏ��Yanofsky��1979�N�ɏo�������ɃG���K���g�ȉ����ł���B
�@�ŋ߁AB. subtilis
�i�͑��ہj�̃g���v�g�t�@���I�y�����̉�͂��i�݁A�g���v�g�t�@�����݉��œ]�ʂ������ɒ�~���Z��mRNA���O���@�\�ɂ��āA�V���������킩�����B�����Atryptophan
attenuation protein (TRAP)�̊֗^�ł���BTRAP��75�A�~�m�_����Ȃ�A11�ʑ̂��`������B�g���v�g�t�@��������11�ʑ̂Ɍ�������ƁA11�ʑ�TRAP��mRNA�̃g���v�g�t�@���R�h����11�����ʂɌ������AmRNA�̂Q���\����]�ʏI���Ɏ���\���ɕς���iAntson
et al, Nature, 401, 235-254, 1999)�B |
|
 |
�@
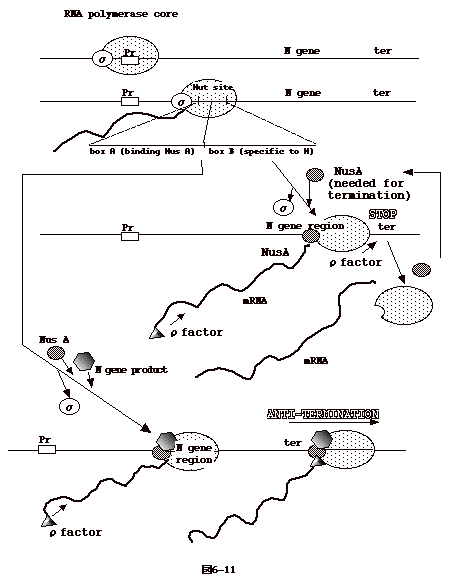
6�|11�F������̓]�ʏI�~�j�Q(antiterminatioin)
�@�` ����RNA polymerase�̑��ݍ�p������������ anti-termination
������B�����_�[�t�@�[�W�ł́A������`�q�̓]�ʂ��ςނ�RNA
polymerase�͓]�ʂ��~�߂�B������`�q�ł���N�`���͂���RNA polymerase�Ƒ��ݍ�p�����āARNA
polymerase������ɉ����̓]�ʂ��\�ɂ���B
�@���j�זE�ł̓]�ʒ�~�͎��̂Q�̌^������B
�@�ψ��q�Ɉˑ����Ȃ�����
�@�ψ��q�Ɉˑ��������
�@�O�҂͓]�ʂ��œ_���i�ނ� mRNA ��3'���ɓ����I�ȃw�A�s���\�����o���Ă��ꂪ�V�O�i���ƂȂ�RNA
�|�������[�[�� RNA
����O��A�]�ʂ��~�܂���̂ł���B�g���v�g�t�@���I�y������trpL�|���̓]�ʒ�~�͂��̗�ł���B��҂͓]�ʒ�~�Ƀψ��q��K�v�Ƃ�����̂ł���B
�@�m�`���́A�ψ��q�ˑ����]�ʒ�~�Ɋ֗^����BRNA�|�������[�[���]�ʊJ�n�_��F������ɂ̓Ј��q���K�v�ł��邪�A�]�ʒ��ɂ��镔�ʂɗ���ƃЈ��q��
�h��Nus�`���ƒu�����B�]�ʏI�~�Ɋւ��ψ��q�� mRNA ��5'����mRNA
�ɏ������3' ���̕��Ɉړ�����BNus�`��- RNA
�|�������[�[���]�ʏI�~�_������ƁA�ǂ����ė����ψ��q�̍�p�ɂ��A�]�ʕ����̂�DNA����O���B
�@�Ƀt�@�[�W��N�`����Nus�`��- RNA �|�������[�[�����̂� nut���ʂŔF����N�`��-
Nus�`��- RNA
�|�������[�[�����̂����B�����Ȃ�ƁA�ψ��q�����Ă��]�ʕ����̂͒��^
DNA����O�ꂸ�]�ʂ������B���ꂪ N�`���ɂ�� anti-termination
�ł���i�}6-11�j�B |
|
 |
�@
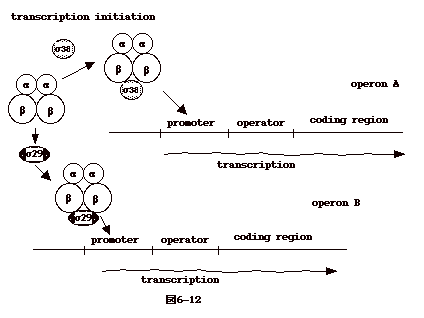
6�|12�F�V�O�}���q�ɂ��]��operon�̑I��
�@�V�O�}���q( ��factor ) �� RNA polymerase��complex ������Ă���A�ǂ�promoter��I�Ԃ������߂�B�ۂ��E�q���������A�t�@�[�W�i�ۂɊ�������E�C���X�j���h���`�q����t�@�[�W��`�q�̓]�ʂɃX�C�b�`���ւ��鎞�ȂǁA�啝�ȑ�ӂ̕ω��������炷�ꍇ�ɂ悭���p�����B
�@Bacillus subtilis�ł͑��B���ɂ�sigma 37�𗘗p���邪�A�E�q�`�����n�܂��
sigma 29 �ɃX�C�b�`�����B�܂��A���̋ۂ� SP01�t�@�[�W�Ɋ�������ƁA�t�@�[�W�̃R�[�h����
sigma gp 28�� RNA polymerase��������B���̂悤�ɂ��āAsigma
���q�ɂ��ǂނׂ���`�q�Q�����߂���ƁA���̈�`�q�Q�����ǂ߂Ȃ��Ȃ�B |
|
 |
�@
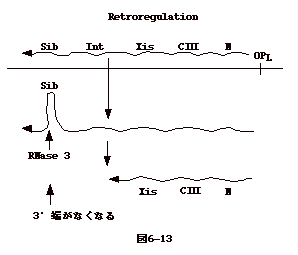
6�|13�FRetroregulation�FmRNA�̕��������ɂ�锭������
|
| �@mRNA
�̈��萫�͈�`�q�����ɑ傫�ȉe����^����B�����_�t�@�[�W���h��ɗn�ۓI�Ɋ�������Ɓi��q�j�A
N ��`�q�̏㗬���� �n�܂��āAN, cIII, xis, int, sib
���܂ޗ̈悪�]�ʂ����B���̗l�� RNA �� sib
�̈�łQ���\�����Ƃ邪�A���̂Q���\�����h��� RNAase�V�ɔF������
xis�̂R'���M���M���܂ł������Aint���R�[�h����̈悪�����Ȃ�B����ɂ��A�n�ۃT�C�N���ɂ͕s����
int�`���i�t�@�[�WDNA �̐��F��DNA�̑g�ݍ��݂ɕK�v�j�͏o���Ȃ��Ȃ�B�����retroregulation�Ƃ����B |
|
 |
�@
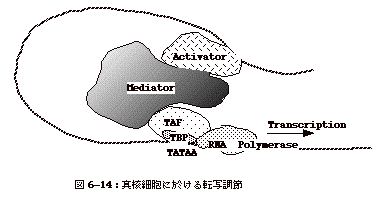
6�|14�F�^�j�זE�ɉ�����]�ʒ���
�@�����ŁA�^�j�זE�̓]�ʒ��߂ɂ��ȒP�ɐG��Ă����B
�@�Ⴆ�A�q�g�Q�m����100,000�̈�`�q�����Ɛ��肳��Ă��邪�A���̂悤�ȑ����̈�`�q���i�K�ɉ����Đ��m�ɔ���������ɂ́A���ׂȒ��߂��K�v�ł��邱�Ƃ��\�z�����B����ɂ͑����̒��߈��q���K�v�Ƃ����ł��낤�B���ہA�ۂƂ͈قȂ�A�����̒`�����]�ʂɊւ��Ă���B
�@�傫��������ƂR�̃J�e�S���[�ɕ�������BActivator�AMediator
complex�A RNA polymerase���܂ފ�{�]�ʕ����́ibasal transcription complex�j�ł���i�}6-14�j�B
�@Activator�͐^�j�זE�ɂ͐��S�킠��Ɖ]���Ă���B��`�q���ʂ�����藣��đ��݂���enhancer�z���Activator�͌�������B��{�]�ʕ����̂�TBP�iTATA
binding protein�j�ATAF (TBP-associated factor�j�ARNA polymerase����Ȃ�ATBP��promoter�z��ɂ���TATAA�z���F������������ʂ����B�܂�A�ۂ̃Ј��q�Ɏ������������Ă���B
�@Activator��promoter���ʂɌ���������{�]�ʕ����̂Ƒ��ݍ�p���A�]�ʂ��n�܂��ł��邪�A���ڑ��ݍ�p����ꍇ�����Amediator������co-activator�����҂̑��ݍ�p�𒇉�邱�Ƃ������Bmediator��20�����͂���ȏ�̃y�v�`�h����Ȃ�600-1,000kDa����ȕ����̂ł���B���̓����́A(1)��X�̈قȂ���activator�����mediator�����̂Ƒ��ݍ�p�����邱�ƁA(2)�قȂ���mediator�Ԃœ���subunit�`�����V�F�A���Ă��邱�ƁA�ł���B����subunit���قȂ��������̂ŃV�F�A�o����A����ꂽ���ii�Ԗڂ�subunit��Ni��ނ���Ƃ���j��subunit�`���ł��A������subunit�i20�Ƃ���j����o���Ă���̂ŁA����ނ���mediator�����̂���肦�邱�ƂƂȂ�iN1
x N2 x N3 x ........N20�j�B�������āA�e�X�̈�`�q�ɓ��ِ��̂��钲�߂��\�ƂȂ�B���A����mediator�����̂�activator�ԂŃV�F�A�o���邱�Ƃ́A���activator�ɂ��قȂ�����`�q�����߂ł���A�܂萔�����̈�`�q�𐧌�ł���Ɖ]�����Ƃł���iNature,
399,199-200 (1999)�j�B |
|
 |
| �@���R�̎��ł��邪�A�����̓]�ʂɊւ����q�͍זE���ō���A�j�Ɉڍs����B�]���āA�j�ڍs���߂͓]�ʒ��߂̈�i�K�ƂȂ�B�Ⴆ�ANFkB�͍זE����IFkB�ƌ������Ă��邪�A����̃P���J�C�����זE�\�ʂ̎�e�Ɍ�������ƁAIFkB���ӎ_������ubiquitin���t����������B�����IFkB���O�ꂽNFkB�͊j�ֈڍs���A����̈�`�q�̓]�ʂ�U������B �@Ubiquitination
�@ubiquitin���t�����Ƃ�ubiquitination�ƌĂԂ��A�זE���ł̒`���̕����ɕK�{�ȉߒ��ł���Bubiquitination�ɂ͕����̍y�f���֗^���Aubiquitin�̕t�����`����proteasome�ƌĂ��\���̂̒��ŕ��������B
�@�זE���̕s�v�ȃV�O�i���i�����A�`���̍y�f�@�\�j������������ׂɂ͂��̍y�f�����Ȃ���Ȃ�Ȃ��B�T�C�g�J�C���Ŏh�����ꂽ�זE���ɂƂ�ƁA���̍זE�ŃT�C�g�J�C���̃V�O�i�����`�B����ɂ́A������IkB�̃V�O�i���������Ȃ���Ȃ�Ȃ��B�זE�������l����ƁA�זE��������肭���ɂ́A����̍y�f�`�����^�C�~���O�悭���̎������@�\����K�v������B���ׂ̈ɂ͒`������������邾���ł͕s�\���ŁA�v��Ȃ��Ȃ����璼���ɖ����Ȃ��Ė��Ȃ���Ȃ�Ȃ��B���̗l�ɍl����ƁA�Ɖ]���ꌩ�Y�I�ȉߒ��������̍y�f�ɂ�蒲�߂��Ă��鎖�͗��Ɋ��������ł���B
6�|15�F mRNA����`���ւ̖|��
�@mRNA�̎�����`���ɓǂݎ���́A���{�\�[���ł���B�`�������́A�R�̃X�e�b�v����Ȃ�B�J�n�iinitiatioin�j�A�L���ielongation�j�A�I�~�itermination�j�ł���B
�@�ŏ��ɋN���邱�Ƃ́A���ʂȌ`�̃��`�I�j���̕t����fMet tRNA�iN-formylethionyl
tRNA�j��mRNA��30S ribosome�ɕt�����Ƃł���B�����ŁAfMet tRNA��anticodon�ɂ��AmRNA�̊J�n�R�h��AUG�ƌ������Ă���B���̃��{�\�[����̏ꏊ��P
site �Ɖ]���B����ɁA50S subunit���t���L���������n�܂�B�A�~�m�_�̕t����tRNA�����{�\�[����A
�iacceptor�jsite�ɂ�P �ipeptidyl�jsite�̐L�����̃y�v�`�h��C���A�~�m�_�Ǝ��X�ɏd������B�����̔����ɂ͕����̖|��J�n���q�A�|��L�����q�`���A�G�l���M�[���Ƃ��Ă�GTP���K�v�Ƃ����B�|��̒�~�͖|���~�R�h���ɂ��B
�@���{�\�[���͕����̃��{�\�[���`���ƃ��{�\�[��RNA����Ȃ�i�ۂ̏ꍇ�A�`���͏��Ȃ��Ƃ�50�ARNA�͂R�j�B���q�ʂ����ɑ傫���i�ۂ̃��{�\�[���̕��q�ʂ�2.6x10�U�_���g���j�B���̃��{�\�[������Ƃ��āA�L�����̃y�v�`�h���ɃA�~�m�_�������]�ڂ��`���������N�����ł���B�����ŋN����^��́A���̔������s���̂͂ǂ̕��q���Ɖ]�����Ƃł���B���{�\�[���̒`�����ARNA���A�����͂���ȊO�̍y�f���A�Ɖ]�����ł���B�ŋ߁A�咰�ۂ̃��{�\�[���̍\����͂���A���̔�����G�}����̂͒`���ł͂Ȃ����{�\�[����23SRNA���A���̃��{�U�C�������ɂ��A�A�~�m�_�̃y�v�`�h���ւ̓]�ڂ�G�}����̂ł͂Ȃ����A�ƍl�����n�߂Ă���B
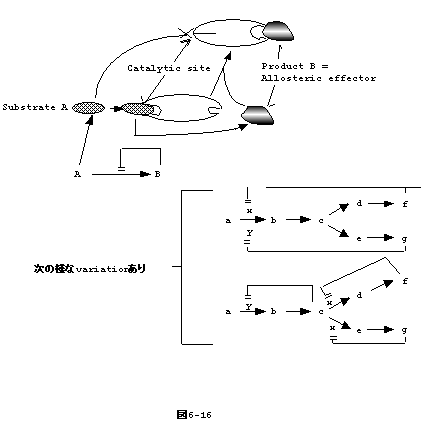
6�|16�F�y�f��������(Regulation of Enzyme Activity)
�@��ɏq�ׂ��̂́AmRNA�̔������߂�����y�f�ʂ̒��߂ł���B���̑��̒��߂Ƃ��ẮA�o���オ�����y�f�̊�����ς�����̂�����B��ɏq�ׂ��AIIIGlc
�������_������IIIGlc-P �ƂȂ�adenylate cyclase������������̂́A���̈��ł���B
�@�\�Ƃ��ē����B
- Covalent modification:
�� phosphorylation, adenylation, acetylation, methylation
- Ligand binding, modulator binding
�@�P�D�̓����_���A�A�f�j�����Ȃǂɂ��y�f�����̕ω��ł���B
�@�Q�D�́Aallosteric inhibition�Ƃ��Ă��BA �̕������y�f E
�Ɣ�����B �̕������o����Ƃ���BB ����R����� E �Ɣ����� A
��F�������Ȃ�����BA �� B
�Ƃ͍\���I�ɉ����W�Ȃ��̂ŁA��̋����ł͂Ȃ��i�}6-16�j �B
�@�l���Ă݂��A �� B
�Ƃ���`�I�Ɍ��ѕt������̂͂Ȃ��B�ǂ����āA���̂悤�ȋ@�\���ł����̂��A�i���_�I�ɓ�ł���B
�@Embden�Meyerhof Pathway, TCA Cycle�ł����̃P�[�X�͑����݂���B
�@phosphoenolpyruvate �� fructose-6-phosphate ����fructose�1,6-phosphate
�ւ̔�����}�����Acetyl-CoA �� pyruvate ���� Acetyl-CoA �ւ̔�����allosteric
�ɗ}������B |
|
 |
�@
6�|17�F�^�j�זE�ɉ�����`���̊j���A��
�@�ۂƈقȂ�A�^�j�זE�͊j�����B�����A�j�ƍזE���̂Q�̃R���p�[�g�����g�������ƂɂȂ�B�`���ɂ��A�j�A�זE�����ꂼ��ɋǍ݂���K�v������B���ꂪ��肭�s���Ȃ��Ɛ܊p�`���Ƃ��Ĕ������Ă��@�\���Ȃ��B
�@�Ⴆ�A���{�\�[��RNA�irRNA�j�͓]�ʂ�����{�\�[���`���Ɗj���ʼn���A���{�]�[���ƂȂ�B�`���͑��čזE���ŏo����̂ŁA���{�\�[���`���͐悸�זE������j�Ɉڍs����K�v������B����o���オ�������{�\�[���͍זE���Œ`�������Ɏg�������A�j����זE���ɏo�čs���Ȃ���Ȃ�Ȃ��B���̂悤�ɂ��āA�^�j�זE�ł͊j�ƍזE���̊Ԃ̒`���̍s�������זE�@�\����ɏd�v�ƂȂ�B
�@����ɒ`���̊j�[�זE���̍s�����̋@�\�����炩�ɂȂ��ė��Ă���A�}6-17�͂��̖͎��}�ł���B�j���ɂ͍E������inuclear
pore�j�A�`���͂�����ʂ�B
| |
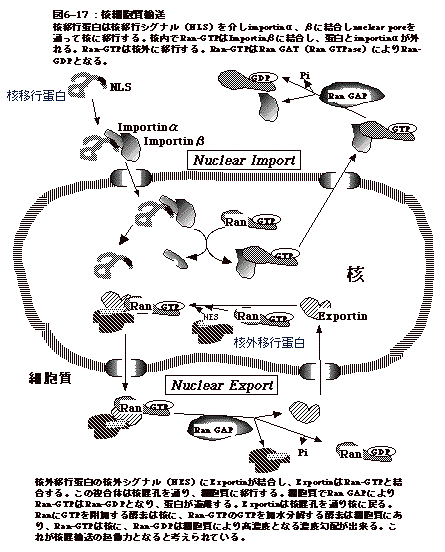 |
| �זE������j�ւ̈ڍs�ɂ�importin�A�j����זE���ւ̈ڍs�ɂ�exportin���W���A������̏ꍇ�ɂ�GTP�����^��Ran���֗^����B���A�j�ڍs�`���ɂ�nuclear
localization signal (NLS)�A�j����זE���֏o��`���ɂ�nuclear export signal
(NES)������B �@mRNA�����Ȃ��Ƃ�20��̒`���̉����hnRNP
(heterogenous nuclear RNA)�̌`�ő��݂��A�j����זE���Ɉڍs����B���炭�AhnRNP�̒`����NES�Ɏ����A�~�m�_�z���͍\��������A���ꂪ�j�O�A���̋@�\�ɔF������A�`���Ƃ̕����̂Ƃ��Ċj�O�ɏo�����̂ł��낤�B |
|
|
|
|
�@
6-18�F�`���̃X�v���C�V���O�Aintein
1990�N���A�y��̈�`�q�������������Ă���r���ŁA�R�[�h�̈悪�����`������ꡂ��ɑ傫���ɂ��ւ�炸�ARNA intron��������Ȃ����ۂɑ������A�`�����x���ňꕔ�̐�o��������̂ł͂Ȃ����A�Ɛ��肳�ꂽ�B�������A��o���O�ɓ����鍂���q�̒`�������o����Ȃ��̂ŐM�p����ʂ܂܂ł������B
�@1993�N�APerler�����A���������Ɛ��肳��镔���ɂ�����z���ʂ̒`���ɑ}�����ቷ�Ő������A���̏�ʼn��x���グ�Ă��ƁA���̕�������o����鎖������B�ȗ���R�̕��オ���Ă��āA�f�[�^�x�[�XInBase (www.neb.com/neb/inteins.html) ���o���Ă���B
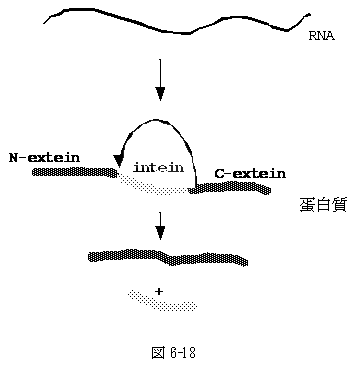
�@�@�@�\�Ƃ��Ă͒`������ݍ��܂ꗧ�̍\�������Ɠ����Ɏ��R��intein�̂b�����z��iC-extein�j��N���z��iN-extein�j�Ɏ��t���Ē�����intein�������O���Ɖ]�����̂ł���B���x��pH�̕ω���intein�̐�o�����R���g���[���o����̂ŁA�Ⴆ�A�h��ɓŐ��̂���`�����������ꍇ�A���̈�`�q�̒���intein�z���}�����Ĕ��������A�������ApH��ς���intein���������ړI�̒`��������Ȃlj��p�ʂ��L���B |
|
|
|
|